(苏教版)高一化学上学期总复习检测题(二)
班级 学号 姓名
说明:本试卷3页,共100分,考试时间60分钟
可能用到的相对原子质量:H:1 O:16 C:12 N:14 Na:23 S:32
第一部分选择题
一、选择题(本题包括16小题,每小题3分,每小题只有一个选项符合题意。)
1.据新华社报道,我国科学家首次合成了镅的一种新同位素![]() ,它和铀
,它和铀![]() 比较,下列叙述中正确的是
比较,下列叙述中正确的是
A、它们互为同位素 B、原子核中的中子数相同
C、具有相同的质量数
D、![]() 比
比![]() 多3个中子
多3个中子
2.下列物质的用途错误的是
A 硅是制造太阳能电池的常用材料 B 二氧化硅是制造光导纤维的材料
C 水玻璃可用作木材防火剂 D 硅是制取水泥的原料
3.下列叙述正确的是
A 纯碱、烧碱均属碱 B SiO2、SO2均属酸性氧化物
C 凡能电离出H+的化合物均属酸 D 盐类物质一定含有金属离子
4.绿色植物是空气天然的“净化器”,研究发现,1公顷柳杉每月可以吸收160kg SO2,则1公顷柳杉每月吸收的SO2的物质的量为
A 164kg B 2.5mol C 2500mol D 2500g/mol
5.现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色;②石蕊试剂;③品红溶液
A ①②③ B 只有①③ C 只有②③ D 只有①②
6.下列气体不能用排水集气法收集的是
A NO B NH3 C O2 D CO
7.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是
A 偏二甲肼(C2H8N2)的摩尔质量为60g
B 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C 1 mol 偏二甲肼(C2H8N2)的质量为60 g/mol
D 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
8.下列化学方程式中,不能用H++OH-=H2O表示的是
A 2NaOH+H2SO4=Na2SO4+2H2O
B Ba(OH)2+2HCl=BaCl2+2H2O
C Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
D KOH+HCl=KCl+H2O
9.下列各组中的离子,能在溶液中大量共存的是
A H+ Na+ CO32- Cl- B Ba2+ Na+ Cl- SO42-
C K+ H+ SO42- OH- D Ag+ Al3+ NO3- H+
10.下列情况会对人体健康造成较大危害的是
A 自来水中通入少量Cl2进行消毒杀菌
B 用SO2漂白食品
C 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D 用小苏打(NaHCO3)发酵面团制作馒头
![]()
![]() 11.如图所示的实验中,投入铝片后
铝
11.如图所示的实验中,投入铝片后
铝
![]()
![]()
![]()
![]() A ①中产生气泡,②中不产生气泡
片
A ①中产生气泡,②中不产生气泡
片
B ①和②中都不产生气泡 稀HCl NaOH溶液
![]()
![]()
![]()
![]() C ①和②中都产生气泡,①中是H2,②中是O2
C ①和②中都产生气泡,①中是H2,②中是O2
D ①和②中都产生气泡,且都是H2 ① ②
12.下列物质存放方法错误的是
A 铝片长期放置在不密封的纸盒里 B 漂白粉长期放置在烧杯中
C FeSO4溶液存放在加有少量铁粉的试剂瓶中 D 金属钠存放于煤油中
13.在实验室中,对下列事故或药品的处理正确的是
A 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场
B 金属钠着火燃烧时,用泡沫灭火器灭火
C 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D 含硫酸的废液倒入水槽,用水冲入下水道
14.吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是
A 作还原剂 B 作氧化剂
C 既作氧化剂又作还原剂 D 既不作氧化剂又不作还原剂
15.在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是
A Fe2+ B Fe3+ 和Fe2+ C Cu2+ 和Fe2+ D Cu2+
16.一定量的浓硝酸与过量的铜充分反应,生成的气体是
A 只有NO2 B 只有NO C NO2和NO D NO2和H2
第二部分非选择题
二、本题包括2小题,
17.(6分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
18.(10分)汽车尾气中的NO,是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体的血管系统内又有传送信息的功能,有三位教授因此项研究成果而获得1998年诺贝尔奖
(1)从上述事实说明我们应如何辨证地看待化学物质的作用
。
(2)写出NO造成酸雨的两个化学反应方程式 。
(3)在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为无毒气体,该反应的化学反应方程式为 。
三、本题包括2小题,
19.(6分)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有 离子,一定不含有 离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程) 。
20.(12分)现有金属单质A.B.C和气体甲、乙、丙及物质D.E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
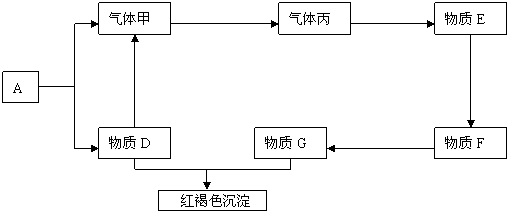 黄绿色气体乙
水
黄绿色气体乙
水
②
水 金属B 金属C
① ③ ④
黄绿色气体乙
⑥ ⑤
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A 、 B 、 C 、
F 、 H 、 乙
(2)写出下列反应化学方程式:
反应①
反应⑤
反应⑥
四、本题包括5小题,
21.(6分)用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③100mL量筒;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为 。
22.(6分)有三瓶标签脱落的无色透明溶液,分别是稀盐酸、稀硫酸和稀硝酸。请你帮助实验老师设计两种方法鉴别它们,并贴上标签。
| 操 作 步 骤 | 现 象 及 结 论 | |
| 方法一 | ||
| 方法二 |
23.Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用Al、稀硫酸、NaOH溶液为原料制备一定量的Al(OH)3。分别设计了两种实验方案:
方案一:Al ![]() Al2(SO4)3
Al2(SO4)3 ![]() Al(OH)3
Al(OH)3
方案二:Al ![]() Na Al
O2
Na Al
O2 ![]() Al(OH)3
Al(OH)3
(1)从节约药品的角度思考,你认为哪一种方案好? ,方案一和方案二共同存在的问题是
。
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的离子方程式
。
24.(1)滑石的化学式为Mg3(Si4O10)(OH)2,其氧化物的形式为 。
(2)镁橄榄石的化学式可表示为2MgO·SiO2,它的硅酸盐的形式为 。
(3)小苏打粉剂、氢氧化铝胶囊、三硅酸镁都可以用来治疗胃酸过多,而三硅酸镁不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁Mg2Si3O8·nH2O改写成氧化物的形式为 。
它中和胃酸(HCl)的化学方程式是 。
25.有一学生取两份A溶液做实验,实验步骤和实验现象如下所示(C不考虑是微溶物)。
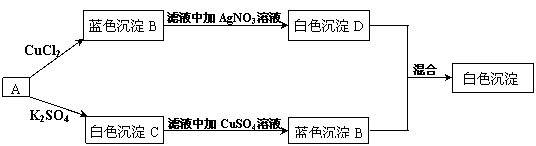
|
|
(1)写出化学式:A. 、B. 、C. 、D. 。
(2)写出下列反应的离子方程式。
![]() A B
A B
![]() A C
A C
五、计算题:(本题共2小题,)
26.有两种铁的氧化物A和B分别重0.4 g和0.435 g,在加热情况下,均用足量CO还原,把生成的CO2分别通人足量的澄清石灰水,均得到0.75 g沉淀。试确定两种铁的氧化物的化学式。
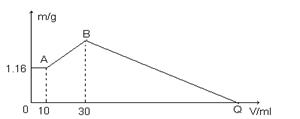 27. 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。试回答:
27. 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示。试回答:
(1)A点的沉淀物的化学式为 ,B点的沉淀物的化学式为 。
(2)原混合物中MgCl2的质量是 g,AlCl3的质量是 g,NaOH的质量是 g。
(3)Q点HCl溶液加入量是 ml。
高一化学上学期总复习检测题(二)参考答案
第一部分选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | D | B | C | A | B | B | C | D | B | D | B | A | A | A | C |
第二部分非选择题
17.(1)2Cl2 + 2 Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O (2)Ca(ClO)2
(3)Ca(ClO)2 + CO2 + H2O == CaCO3↓+ 2 HClO (4) (1)
18.(1)“科学是把双刃剑”,我们要充分利用化学物质为人类造福,又要正视化学物质给人类带来的问题,并利用科学的方法解决这些问题(或其它相近的意思)。
(2)2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
![]()
(3)2NO+2CO N2+2CO2
19.Ag+、Ba2+、NH4+ ;Fe3+ ; 焰色反应,产生紫色火焰
20.(1)A:Na B:Al C:Fe F:FeCl2 H:Fe(OH)3 乙:Cl2
(2)反应①:2Na + 2H2O == 2NaOH + H2↑
反应⑤:2FeCl2 + Cl2 == 2FeCl3
反应⑥:FeCl3+ 3NaOH == Fe(OH)3↓+ 3NaCl
21.(1)①②④⑥⑦ (2)10.6 g
22.(合理的答案均可,但都必须有操作、现象、结论的叙述)
| 操 作 步 骤 | 现 象 及 结 论 | |
| 方法一 | (1)各取少量溶液于试管中,分别滴加BaCl2溶液 (2)各取剩余的两种溶液于试管中,分别滴加AgNO3溶液 | 产生白色沉淀的是稀硫酸 产生白色沉淀的是稀盐酸,剩余的是稀硝酸 |
| 方法二 | (1)各取少量溶液于试管中,分别加入铜片 (2)各取剩余的两种溶液于试管中,分别滴加BaCl2溶液 | 有气泡产生的是稀硝酸 产生白色沉淀的是稀硫酸,剩余的是稀盐酸 |
23. (1)方案二; 均难控制加入试剂量,难以保证铝元素全部转化为氢氧化铝
(2)将铝粉均分为四份,其中一份加硫酸,其余三份加氢氧化钠溶液,使铝恰好全部溶解,再将二种溶液混合即可。2Al + 6H+===2Al3+ +3H2↑, 2Al+2OH- +2H2O===2AlO2-+3H2↑,Al3+ +3AlO2- +6H2O====4Al(OH)3↓
24. (1)3MgO·4SiO2·H2O;(2)Mg2SiO4(3)2MgO·3SiO2·nH2O,2MgO·3SiO2·nH2O+4HCl===2MgCl2+3SiO2+ (n+2)H2O ;
25.(1)A Ba(OH)2 B Cu(OH)2 C BaSO4 D AgCl ;
(2)Cu2+ +2OH- =Cu(OH)2 ↓ Ba2+ +SO42- =BaSO4↓;
26. Fe2O3、Fe3O4
27. (1)Mg(OH)2 、 Al(OH)3和Mg(OH)2
(2)1.9克, 2.13克, 5.2克(3)130ml