(苏教版)高一化学上学期总复习检测题(三)
班级 学号 姓名
可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64 Ag:108
C:12 O:16 S:32 Cl:35.5 Br:80 N:14
一、选择题(本题包括8小题,每小题4分,共32分,每小题只有一个正确答案)
1.有同学将NaOH固体、P2O5固体、无水CaCl2固体划分为一类。据此分类,下列A-D选项中能与这三种物质归为一类的是 ( )
A.浓硫酸 B.CaO C.碱石灰 D CuSO4 晶体
2.科学界最近发现两种粒子。第一种只由四个中子构成,被称为“四中子”,也有人称“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法中,不正确的是( )
A.“四中子”不显电性 B.“四中子”的质量数为4
C. 第二种粒子是氧元素的另一种同位素 D.第二种粒子的化学式为O4
3.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列性质与这些用途无关的是 ( )
A.导电、导热性好 B.不易生锈 C.密度小 D.强度高
4.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )
A.NaOH溶液[Ba(OH)2溶液] B.FeSO4溶液(KSCN溶液)
C.KI(淀粉溶液) D.Na2SO3溶液(BaCl2溶液)
5.用98%、密度为1.84g/cm3的浓H2SO4配制l mol/L的稀硫酸100mL,现给出下列可能用到仪器:①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒:按使用仪器先后顺序排列正确的是
A.②③⑦⑤⑥ B.②⑤⑦⑥ C.①③⑤⑦④⑥ D.④③⑦⑤⑥
6.下列各组物质中,不能按右(“→”表示一步完成)关系相互转化的是 ( )
| a | b | C | |
| A | Si02 | →Na2Si03 | →H2Si03 |
| B | NO | →N02 | →HN03 |
| C | C | →CO | →C02 |
| D | Al(OH)3 | →NaAl02 | →A1203 |
7.2004年4月16日,重庆天原化工总厂发生了氯气泄漏及爆炸特大事故,喷出的氯气造成了多人伤亡。作为现场的消防干警下列处理方法和过程较合理的是
①及时转移疏散人群,同时向有关部门如实报告事故的有关情况;②被转移人群应戴上用浓NaOH处理过的口罩;③用高压水枪向空中喷洒含碱性物质的水溶液解毒;④被转移人群可戴上用Na2CO3处理过的口罩(湿润);⑤将人群转移到地势较低的地方;⑥及时清理现场,检查水源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
A.②③④⑤ B.①③④⑥ C.①②⑤⑥ D.①③⑤⑦
8.某学生用一定物质的量浓度的稀硫酸和氧化铜进行反应,实验结果如下:
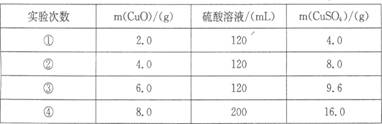
由上表数据可知稀硫酸和氧化铜恰好完全反应的是第( )次实验
A.① B.② C.③ D.④
二、选择题(本题包括10小题,9-16题每小题4分,17-18每小题5分,共42分,每小题有一至两个正确答案)
9.不用其他试剂无法鉴别的一组溶液是 ( )
A.氯化铁溶液和氯化铜溶液 B.硫酸钠溶液和氯化钠溶液
C.氯化铝溶液和氢氧化钠溶液 D.硫酸氢钠溶液和碳酸钠溶液
10.自来水常用氯气进行消毒。某实验室用自来水配制下列物质的溶液,不会产生明显药品变质问题的是 ( )
A.FeCl2 B.Na2SO3 C.NaOH D.AlCl3
11.将铜粉放入稀硫酸中,加热无明显现象发生。但加入某盐后,发现铜粉质量逐渐减少,则该盐可能是 ①.Fe2(SO4)3 ②ZnSO4 ③.KNO3 ④NaCl ( )
A ①② B. 只有① C ①③ D.③④
12.对于某酸性溶液(可能含有Br –、SO42 –、H2SO3、NH4+),分别进行如下实验:
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列物质不能确定其在原溶液中是否存在的是 ( )
A.Br – B.SO42– C.H2SO3 D.NH4+
13.等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1︰2︰3,则三种硫酸盐溶液的物质的量浓度比为 ( )
A. 1︰2︰3 B. 1︰6︰9 C. 1︰3︰3 D. 1︰3︰6
14.目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是: ( )
A.明矾 B.二氧化氯 C.臭氧 D.高铁酸钠( Na2FeO4)
15.卫生部规定食盐中必须加碘,其中的碘以碘酸钾(KIO3)的形式存在。已知酸性溶液中KIO3和KI可发生反应生成I2和H2O。据此信息,可用一些常用试剂,甚至生活用品进行实验,证明食盐中是否加碘。可供选用的物质有:①自来水 ②蓝色石蕊试纸③碘化钾淀粉试纸 ④淀粉 ⑤食醋 ⑥白酒等,进行上述实验必须使用的物质是
A、①③ B、④⑤ C、③⑤ D、②③④⑤
16.下列离子方程式书写正确的是 ( )
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液:
Ca2+ + HCO3-+OH-=CaCO3 ↓+ 2H2O
B. 用氨水吸收过量的二氧化硫 NH3·H2O +SO2=NH4+++HSO3-
C.次氯酸钙溶液中通人过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D.氯化亚铁溶液中加入硝酸:2Fe2++4H++NO3-=2Fe3++2H2O+NO↑
17.纯碱和小苏打是厨房中两种常见用品,它们都是白色固体,下列区分它们的说法正确的是( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,使火焰颜色发生明显变化的是小苏打
C.用两只小玻璃杯,分别加入少量的两种样品,再加入等浓度的食醋,产生气泡速率较快的是小苏打
D.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
18.将22.4g铁粉逐渐加入到含HNO30.8mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是 ( )
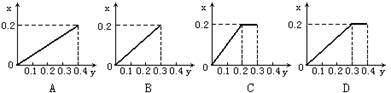 |
三、本题包括两小题,共21分:
19.(9分)解释下列有关实验现象,并写出有关化学方程式:
(1)向氨水中滴几滴酚酞试液,溶液变红色:
(2)两只棉球分别滴有几滴浓氨水和浓盐酸放入同一只烧杯中,用表面皿盖住烧杯口,烧杯内有白烟:
(3)一瓶无色气体打开瓶盖后,瓶口呈现出红棕色:
20.(15分)海水的综合利用可以制备金属镁。
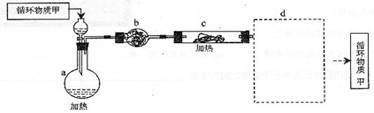
(1)用电解法制取金属镁时,需要无水氧化镁,制取无水氯化镁必须在氯化氢存在的条件下进行。其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
①下图中,装置a是由 、 、双孔橡皮塞、导气管等仪器组成。
循环物质甲的名称是
②装置b中填充的物质可能是 (填入编号)
A.硅胶 B.碱石灰 C. 无水氯化钙 D.浓硫酸
③设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出)。
 |
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
(3)实验室时将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:
过滤时:
蒸发时:
四、本题两小题,共26分:
21.(12分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
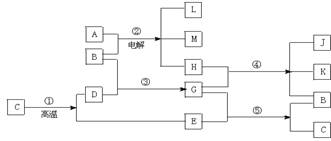
(1)单质L是__________。 (2)化合物B是________。
(3)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。它们的化学反应方程式分别是 和 。
 22.(14分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去。
22.(14分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去。
(1)若A与NaOH反应,既可只生成B, 又可只生成C,还可生成B+C。
①写出符合上述反应关系的A的2种不同类物质的分子式_______;__________.
②任选上述一种物质,写出有关离子方程式:
生成B的离子方程式为 ;
生成C的离子方程式为 。
(2) 若A与NaOH无论以何种物质的量比反应, 其产物必为B+C,则A的分子式可能是__________(只写一种),R在A、 B 、C中的化合价必须满足的条件是________________,该反应的离子方程式为 。
五、本题两小题,共26分:
23.(12分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500mL,每次实验均充分反应。实验记录如下:
| 实验次数 | 样品质量/g | 沉淀质量/g |
| 1 | 1.716 | 2.758 |
| 2 | 2.574 | |
| 3 | 3.432 | 5.516 |
| 4 | 4.290 | 5.516 |
回答下列问题:
(1)第2次实验中产生沉淀质量是多少,将结果填入表格空白处。
(2)Ba(OH)2溶液中溶质的物质的量浓度是 。
(3)第2次实验样品中NaHCO3的物质的量是 。
24.(14分)工业上从铝土矿(含氧化铝、氧化铁等)制取铝的部分流程如下:
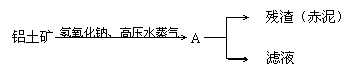
滤液经处理得到Al2O3,再电解得到Al :2Al2O3 ![]() 4Al+3O2↑
4Al+3O2↑
经分析原料和残渣的部分成分见下表:
| Al2O3 | Fe2O3 | |
| 铝土矿 | 55% | 16% |
| 赤 泥 | 15% | 48% |
已知铝土矿中Fe2O3全部转入赤泥,则:
(1)生产中每消耗1t铝土矿,将产生多少t赤泥?
(2)若由滤液到制得产品铝的过程中原料均没有损失,则整个生产过程中Al2O3的转化率为
多少?
(3)每炼出1t铝理论上需铝土矿的质量为多少t ?
高一化学上学期总复习检测题(三)答案
一、选择题(本题包括8小题,每小题4分,共32分,每小题只有一个正确答案)
1. B 2.C 3.A 4.D 5.A 6.D 7.B 8.D
二、选择题(本题包括10小题,9-16题每小题4分,17-18每小题5分,共42分,每小题有一至两个正确答案)
9.B 10. D 11.C 12.B 13.B 14.A 15.B 16.B 17.C 18.C
三、本题包括两小题,共24分:
19.(9分) (略)
20.(15分)
(1)①分液漏斗、圆底烧瓶。 氯化氢 ②A C ③略
(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤
(3)搅拌,加速溶解
引流,使待滤液体沿玻璃棒流入漏斗,防止外洒
搅拌,防止因局部过热液滴或晶体飞溅
四、本题两小题,共26分:
21. (1)H2 (2)H2O (3)② ④ (每空2分)
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
2Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O(每空2分)
22. ⑴①![]() ;SO2 ②生成B的离子方程式为
;SO2 ②生成B的离子方程式为![]() ;生成C的离子方程式为
;生成C的离子方程式为![]() ⑵
⑵![]() ,R在A中的化合价处于B、C中化合价之间,该反应的离子方程式为
,R在A中的化合价处于B、C中化合价之间,该反应的离子方程式为![]() 。(每空2分)
。(每空2分)
五、本题两小题,共26分:
23.(1)4.137(4分) (2)0.056mol/L(4分) (3)0.006mol(4分)
24.⑴![]() (4分) ⑵90.9% (5分) ⑶3.78t(5分)
(4分) ⑵90.9% (5分) ⑶3.78t(5分)