(苏教版)高一化学上学期总复习检测题(四)
班级 学号 姓名
第I卷 (选择题 共45分)
可能用到的相对原子质量: H: 1 N: 14 O: 16 Cl:35.5 Fe:56 Cu: 64 Zn: 65
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
1.据报道某些不合格大理石装潢材料中含产生放射性核素氡 222 86Rn,从而对人体产生伤害。该核素中的中子数和质子数之差为
A.136 B.50 C.88 D.222
2.下列关于物质用途的叙述中,不正确的是
A.硅可以用做制造变压器铁芯的材料
B.二氧化硅可用于制造光导纤维
C.水玻璃可以用作木材防火剂
D.石墨可用作绝缘材料
3.物质在化学反应前后,可能发生变化的是
A.原子总数 B.质子总数 C.电子总数 D.分子总数
4.质子数和中子数相同的原子A,其阳离子An+核外共有X个 电子,则A的质量数为( )
A.2(x+n) B.2(x -n) C.2x D.n+2
5.下列叙述正确的是
A.核素就是同位素
B.元素的金属性强弱与元素失去电子数的多少成正比
C.具有相同质子数的微粒一定是同一种元素
D.核内中子数为N的R2+,质量数为A,则该离子的核外电子数为A-N-2
6.0.1mol某元素的单质直接与氯气反应后,质量增加7.1g。这种元素是
A.Na B.Mg C.Fe D.Al
7.将氢氧化钠溶液滴入某氯化镁和氯化铝的混合溶液中,则下列图像变化趋势正确的是
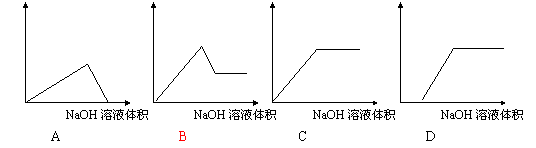 |
8.铜跟1mol/L的硝酸反应,若c(NO3-)下降了0.2mol/L,则c(H+)下降
A.0.8mol·L-1 B.0.6mol·L-1 C.0.4mol/L D.0.2mol/L
9.在无色透明的溶液中可以大量共存的离子组是
A.H+、K+、Fe2+、NO3- B.OH-、Cl-、Na+、NH4+
C.Mg2+、K+、Cl-、NO3- D.Cu2+、NO3-、OH-、Cl-
二、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
10.下列离子方程式正确的是
A.二氧化硅与强碱溶液反应: SiO2+2OH-=SiO32-+H2O
B.将氯气通入水中: Cl2+H2O=2H++Cl-+ClO-
C.金属钠与水反应: Na+H2O=Na++OH-+H2↑
D.少量的金属锌加入到FeCl3溶液中: 2Fe3++3Zn=2Fe+3Zn2+
11.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含 氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为
A.元素 B.单质 C.分子 D.氧化物
12.下列数量的各物质:①0.5molNH3 ,②标准状况下22.4LHe,③4℃时9mlH2O,④0.2molH3PO4中,所含原子个数由大到小的顺序是( )
A.②③④① B.④③②① C.①④③② D.①④②③
13.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
① Cl2+2KI══I2+2KCl ② 2FeCl3+2HI══I2+2FeCl2+2HCl
③ 2FeCl2+Cl2══2FeCl3 ④ I2+SO2+2H2O══2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Cl2>Fe3+>I2>SO2
C.Fe3+>Cl2>I2>SO2 D.Cl2>Fe3+>SO2>I2
14.在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留体积的气体,该气体与空气接触后变为红棕色。则m的n比值为
A.3:2 B.2:3 C.8:3 D.3:8
15.SiO2在高温下可发生反应:SiO2 +3C = SiC +2CO↑→该反应中氧化剂与还原剂的质量比是( )
A.1︰2 B.2︰1 C.1︰3 D.1︰1
第Ⅱ卷 (非选择题 共55分)
三、本题包括2小题
16.(4分)回答下列问题(填序号):
(1)选择下列实验方法分离物质,将分离方法的序号填在横线上。A.萃取分液B.升华C.结晶D.分液 E.蒸馏 F.层 析 G.过滤
①______分离饱和食盐水与沙子的混合物。
②______从硝酸钾和氯化钠的混合液中获得硝酸钾。
③______分离水和汽油的混合物。
④______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
(2)实验室有贮存以下物质的方法:
A.氯水不宜长期存放,短期保存则需避光; B. 浓硝酸用棕色瓶盛放,贮存在阴凉处
C. 通常向盛有溴单质的试剂瓶中加入适量的水 D. 金属钠常保存在煤油中
E.NaOH溶液通常用带玻璃塞的磨口试剂瓶保存;
其中正确的是
17.(11分)请回答有关下列五种气体:H2、O2、NO、NH3、NO2的问题。
I.(1)与制取O2 的发生装置相同的是 ;只能用一种方法收集的是
(2)以上气体制备反应中,有一反应在原理上与其它反应都不能归为同一类型,请写
出实验室制取该气体的方程式
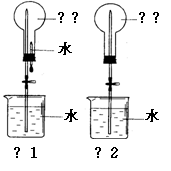 II. 用右图装置进行喷泉实验(图中夹持装置均已略去)。
II. 用右图装置进行喷泉实验(图中夹持装置均已略去)。
(1)若用图1装置进行喷泉实验,上部烧瓶已装满干
燥的氨气,引发水上喷的操作是
该实验的原理是
(2)若用图2的装置,请举一例说明引发喷泉的方法。
III:若用同一烧瓶分别充满如下气体:① HCl ② NH3 ③ NO2进行喷泉实验,实验后烧瓶内溶液液面的高度关系为 (用序号和“>,<或=”表示,下同),所得溶液物质的量浓度大小关系为 。
四、本题包括3小题
18.某校高一研究性学习小组将造成我省某市空气污染的主要原因分为以下四种:
A.燃烧农作物秸秆 B.燃烧含硫煤 C.粉尘污染 D.机动车尾气污染
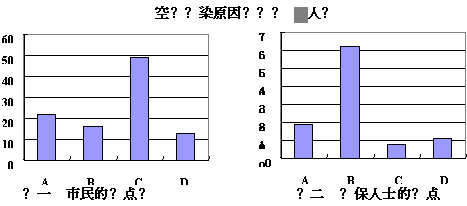 并就造成该市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
并就造成该市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
(1)调查结果显示:该市市民认为造成空气污染的最主要原因是 ,环保人士认为造成该市空气污染的最主要原因是 。
(2)调查结果说明市民对造成空气污染的最主要原因认识不足。该最主要原因造成的大气污染的主要有害成分是 ,空气中该成分含量较高时,在空气中的氧气
和水的共同作用下,会形成酸雾,其化学反应方程式为
(3)下列措施能够减少空气中该成分排放量的是
 ① 用天然气代替煤炭做民用燃料 ② 改进燃烧技术,提高热能利用率 ③ 工厂生产时将燃煤锅炉的烟囱造得更高 ④ 燃煤中加入适量石灰石后使用
① 用天然气代替煤炭做民用燃料 ② 改进燃烧技术,提高热能利用率 ③ 工厂生产时将燃煤锅炉的烟囱造得更高 ④ 燃煤中加入适量石灰石后使用
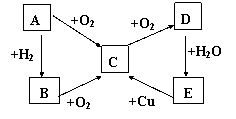
19.(9分)已知A、B、C、D、E五种物质有如图
所示的转化关系(部分反应物及反应条件未列出,
若解题时需要,可作合理假设),且五种物质中均
含有A元素。
(1)若A为固体单质
① D的化学式为 ,
② E→C的化学方程式为
③ 将C通入某非金属单质的溶液中,可发生氧化还原反应生成两种强酸,试举一例写出化学方程式 。
(2)若A为气体单质
① C→D的化学方程式
② E→C的离子方程式为 。
20.某河道两旁有甲乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl-、OH-、NO3-六种杂质离子,甲厂的废水是无色透明的,乙厂的废水有明显的颜色。
(1)甲厂的废水明显呈 性;其中所含三种离子是 ;
(2)乙厂废水有明显的 色;
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填离子符号)化为沉淀,过滤所得的废水中主要含 ,可以用来浇灌农田。
五、本题包括1小题
21.某生欲用 2mol/LNaOH溶液配制0.1mol/LNaOH溶液100 mL,请你帮他完成该实验:
⑴该生应该选用的实验仪器有_________________________________________________。
(2)实验中所需量取2mol/LNaOH溶液的体积为_______________。
(3)该生把量取的NaOH溶液倒入小烧杯中加水稀释冷却后,转移到容量瓶中,即进行定容、摇匀,得到所需的溶液。该生的操作准确吗?如不准确,请你指出他操作中的错误或缺漏之处:___________________________________________________________________________________________________________________________________________。
(4)请你说出该生定容操作应采取的具体方法____________________________________________
__________________________________________________________________________。
六、本题包括1小题
22.(8分)使一定质量的锌与100mL18.5mol/L浓硫酸充分反应。
(1)若锌完全溶解,同时生成标准状况下SO2气体3. 36L,求所
得溶液中硫酸锌的物质的量浓度(假设反应前后溶液体积保持不变)。
(2)若锌完全溶解,同时生成标准状况下混合气体为33.6L,并将反应后的溶液稀释至1L,测得溶液中c(H+)为0.100mol/L,求混合气体中各组分的体积比。
高一化学上学期总复习检测题(四)
参考答案
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | D | A | D | B | B | A | C |
二、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | A | A | D | B | C | A |
16.(1)G (2)C (3)D (4)E (2)ABCD
17.I.(1)NH3 ; NO、NH3、NO2 (3分)
(2)2NH4Cl+Ca(OH)2 △CaCl2+2NH3↑+2H2O (2分)
II.(1)打开止水夹,挤出胶头滴管中的水。(1分)
氨气极易溶解于水,致使烧瓶内气体压强迅速减小。(2分)
(2)打开夹子,用手(或热毛巾等)将烧瓶捂热 (1分)
III.①=②>③ ①=②=③ (3分)
18.(1)C B
(2)SO2 2SO2+O2+2H2O=2H2SO4
(3)①②④
19.(1)① SO3
② 2H2SO4(浓)+Cu △CuSO4 +SO2↑+2H2O
③ Cl2+SO2+2H2O=2HCl+H2SO4
(2)① 2NO+O2=2NO2
② 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
20.(1)碱; K+ OH- Cl- ;
(2) 黄
(3)Ag+ OH- Cl- Fe3+ : NO3-
21.(1)10 mL量筒、玻璃棒、100 mL容量瓶、胶头滴管、小烧杯 (2)5 mL
(3)不准确;(1分)转移完溶液后应用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也一同转入容量瓶中。(2分)
(4)向容量瓶中注入蒸馏水至离刻度线1~2 cm处,改用胶头滴管滴加蒸馏水到溶液的 凹液面正好与刻度线相切
22.(1)Zn + 2H2SO4(浓)![]() ZnSO4 + SO2↑ + H2O
ZnSO4 + SO2↑ + H2O
1mol 22.4L
n(ZnSO4) 3.36L
则X n(ZnSO4)=0.150mol(1分), c(ZnSO4)=1.50mol·L-1(3分)
(2)据题意:反应后c(H2SO4)为0.0500mol·L-1,n(H2SO4)为0.0500mol
Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+H2O
ZnSO4+SO2↑+H2O
2n(SO2) n(SO2)
Zn+H2SO4(稀)=ZnSO4+H2↑
n(H2) n(H2)
![]() 2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1 (4分)
2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1 (4分)
n(SO2)+n(H2)= (5分)
解得: n(SO2)=0.300mol(6分) n(H2)=1.20mol(7分)
则:V(SO2)∶V(H2)=0.300mol∶1.20mol=1∶4 (8分)