高一上学期实验班期末考试化学试题
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 S—32 K—39 Ca—40
一、选择题(每小题只有1个正确答案,每小题2分共10分)
1、人类探测月球发现,在月球土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为( )
A.43He B.32He C.42He D.33He
2、下列氧化物按其形成的含氧酸酸性递增排列的顺序正确的是( )
A.SiO2<CO2<SO3<P2O5 B.SiO2<CO2<P2O5<SO3
C.CO2<SiO2<P2O5<SO3 D.CO2<P2O5<SO3<SiO2
3、某气体的水溶液呈酸性,它能使酸性KMnO4溶液褪色,也能使溴水褪色并出现浑浊,该气体是( )
A.HBr B.H2S C.SO3 D.SO2
4、利用废铜屑制取CuSO4溶液的最佳方法是( )
A.将铜屑与浓硫酸混合加热 B.将铜屑在空气中灼烧后再溶于稀硫酸
C.将铜屑与稀硫酸混合加热 D.将铜屑在空气中灼烧后再溶于浓硫酸
5、检验某未知溶液中是否含有SO42-的下列操作中最合理的是( )
A.加入硝酸酸化了的硝酸钡溶液 B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液 D.加入盐酸酸化了的氯化钡溶液
二、选择题(每小题只有1个正确答案,每小题3分共30分)
6、0.75mol RO32-共有30mol电子,则R在周期表中的位置是( )
A.第二周期 B.第四周期 C.第IVA族 D.第VIA族
7、元素R的原子最外层上有2个电子,下列叙述正确的是( )
A.R一定是第IIA族的元素 B.R的最高化合价一定是+2价
C.R一定是金属元素 D.无法判断R在周期表中的位置
8、为了除去稀硫酸中混有的亚硫酸,所选用的最合理的试剂是( )
A.KMnO4 B.Ca(ClO)2 C.H2O2 D.Cl2
9、下列物质不能通过化合反应得到的是( )
A.CuS B.FeCl2 C.FeCl3 D.NaHCO3
10、向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,该沉淀是( )
A.BaSO4 B.FeS C.BaSO3 D.S
11、对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验
①加热时放出的气体可以使品红褪色
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝色
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸
对于下列微粒不能确定其在原溶液中是否存在的是( )
A.Br- B.SO42- C.H2SO3 D.NH4+
12、关于浓硫酸的说法正确的是( )
A.若不小心粘到手上应立即用纱布拭去,再用大量水冲洗,最后涂上稀NaHCO3溶液
B.稀释时要将水沿容器壁慢慢注入浓硫酸中,并用玻璃棒不断搅拌
C.欲除去H2中混有的H2S和水蒸气,可让混合气体通过盛浓硫酸的洗气瓶
D.浓硫酸难分解、难挥发,所以能敞口放置在空气中
13、下列反应中,调节反应物的用量或浓度不会改变产物的是( )
A.H2S在O2中燃烧 B.Fe在S蒸气中燃烧
C.二氧化硫通入石灰水 D.硫酸中加入Zn粉
14、X、Y、Z三种元素的离子具有相同的电子层结构,原子半径X>Y,离子半径Y<Z,Y和Z能形成离子化合物,由此可知:三种元素原子序数的关系是( )
A.X>Y>Z B.Z>X>Y C.Y>Z>X D.Y>X>Z
15、下列各组粒子中,具有相同的质子数和电子数的是( )
A.OH-、F-、O2-、Ne B.CH4、NH3、H2O、HF
C.NH4+、Na+、H3O+、PH4+ D.F-、O2-、Mg2+、Al3+
三、选择题(每小题有1-2个正确答案,每小题4分共20分)
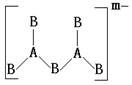 | 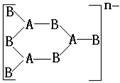 | 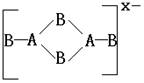 | |||
16、 由ⅢA族元素A和ⅥA族元素B构成的阴离子结构如下:
则m、n、x依次为( )
A.2、3、2 B.2、3、4、 C.4、3、2 D.5、6、4
17、有碳酸盐组成的混合物9.0g,加到足量的稀盐酸溶液中,产生4.4g的CO2气体,则该混合物可能的组成为( )
A.CaCO3和Na2CO3 B.Na2CO3和K2CO3
C.NaHCO3和Na2CO3 D.K2CO3和KHCO3
18、将一小块焦碳和x g O2同时放入一个装有压力表的体积不变的密闭容器中,压强为P0。点燃充分反应后恢复到原温度,压强为P1,且P0<P1<2P0,则加入焦碳的质量m为( )
A.m≤(3x/8)g B.m≥(3x/4)g C.m>(3xP1/8P0)g D.m=(3xP1/8P0)g
19、已知硝酸是氧化性酸,某单质跟足量的浓HNO3反应时,每有0.25mol单质反应就消耗1molHNO3,且还原产物只为NO2,则该单质氧化后元素的化合价可能是( )
A.+1 B.+2 C.+3 D.+4
20、天平两托盘上分别放一等质量的烧杯,各盛等体积,等浓度的稀盐酸溶液,且天平平衡,若一侧放Na2CO3,另一侧放NaHCO3,药品质量相等,则天平( )
A.放Na2CO3的一侧重 B.放NaHCO3的一侧重
C.仍平衡 D.无法判断
高一上学期实验班期末考试化学试题
化学试题答题卷
班级 ,姓名 ,学号 ,得分
一、二、三、选择题(共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
四、填空题(共30分)
21(7分)、在下列物质中:①H2O2;②H2O;③NH4Cl;④CaC2;⑤H2;⑥CaH2;⑦Ar。
(1)只有非极性键的是 ; (2)只有极性键的是 ;
(3)既有极性键又有非极性键的是 ; (4)只有离子键的是 ;
(5)既有离子键又有极性键的是 ; (6)既有离子键又有非极性键的是 ;
(7)无任何化学键的是 。
22(4分)、表中上、下两横行分别是含C、N元素的粒子。纵行,如CH4、NH4+互为等电子体(原子数相同,电子数也相同)。请在表中空格里填入相关粒子的化学式。
| CH4 | CO32- | C2O42- | ||
| NH4+ | NO2+ | N2 |
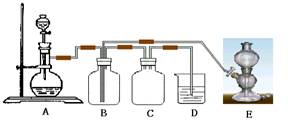 23(8分)、右图是有关硫及其化合物的实验装置,实验中用到的试剂可在下列试剂中选择:①浓硫酸;②中等浓度硫酸;③稀硫酸;④新开封的Na2SO3粉末;⑤FeS;⑥NaOH溶液;⑦溴水;⑧Na2CO3溶液。在实验开始后不久即在B瓶中出现固体粉末状物质。试回答:
23(8分)、右图是有关硫及其化合物的实验装置,实验中用到的试剂可在下列试剂中选择:①浓硫酸;②中等浓度硫酸;③稀硫酸;④新开封的Na2SO3粉末;⑤FeS;⑥NaOH溶液;⑦溴水;⑧Na2CO3溶液。在实验开始后不久即在B瓶中出现固体粉末状物质。试回答:
(1)A装置中反应的化学方程式是 。该反应的速率与H+浓度有关,为了在短时间内逸出较多的气体,则分液漏斗中盛放的试剂是 。
(2)B中反应的化学方程式是 ,该反应的氧化产物与还原产物的质量之比为 。
(3)E中反应的化学方程式为 。
(4)若A、E两装置中气体发生的速率相同,流量也相同,则在D中发生反应的化学方程式为 。
(5)装置D的作用是 ,装置C的作用是 。
24(8分)、已知X、Y、Z、W是短周期中的四种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,1个YX4分子中电子总数为10个。Z单质在通常状况下为无色无味气体。W原子的最外层电子数占核外电子总数的3/4。试回答:
(1)Z是 ,W是 (写元素符号)
(2)X单质和Z单质在一定条件下反应可生成化合物E。写出E的电子式 。
(3)由X、Y、Z、W四种元素可以组成多种常见化合物,写出其中既能与盐酸,又能与烧碱溶液反应的化合物的化学式(共写三种): 、 、 。
(4)将9gY单质在足量W单质中燃烧,所得气体通入1mol·L-1的苛性钠溶液1L中全反应后,所得溶液中酸式盐与正盐的物质的量之比为 。
25(3分)、有Mg、Al、Fe的混合粉末4.4g与适量稀H2SO4 恰好完全反应。将反应后的溶液蒸干,得到不含结晶水的固体14.0g,则反应过程中生成气体体积(SPT)为 L。
五、计算题(共10分)
26(10分)、硫代硫酸钠俗名大苏打,常用作定影液,其制取方法如下:在热的强碱性溶液中加入足量的硫粉,首先发生歧化反应生成S2-和SO32-。这两种生成物继续跟过量的S作用,分别生成Sx2-和S2O32-,充分反应后过滤除去过量的S,向滤液中加入一定量的强碱后再通入足量的SO2,SO2与Sx2-反应也完全转化成S2O32-。
(1)写出以上四个反应的离子方程式
; ;
; ;
(2)若有10mol S 经上述转化后,最终完全变为Na2S2O3,至少需要SO2和NaOH的物质的量各是多少?
(3)若原热碱液中含6 mol NaOH,则在上述10mol S的转化过程中,生成的Na2Sx的x值是多少?
参考答案:
一、二、三、选择题(共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | B | B | C | C | D | C | A | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | A | B | D | B | C | C | D | BD | A |
四、填空题(共30分)
21(7分)、在下列物质中:①H2O2;②H2O;③NH4Cl;④CaC2;⑤H2;⑥CaH2;⑦Ar。
(1)⑤、(2)②、(3)①、(4)⑥、(5)③、(6)④、(7)⑦、
22(4分)、。
| CH4 | CO32- | CO2 | C2O42- | CO或C22- |
| NH4+ | NO3- | NO2+ | N2O4 | N2 |
23(8分)(1)Na2SO3+H2SO4=Na2SO4+SO2+H2O、②;
(2)2H2S+SO2=3S+2H2O、 2 :1 ;
(3)FeS+H2SO4=FeSO4+H2S;
(4)SO2+2NaOH=Na2SO3+H2O
(5)吸收尾气、安全瓶(防止倒吸)
24(8分)、(1)N、O;(2)NH3的电子式(略);
(3)NH4HCO3、(NH4)2CO3、CH3COONH4、NH4CN、NH4CNO、(NH4)2C2O4等;
(4)2 :1
25(3分)、2.24。
五、计算题(共10分)
26(10分)、(1)
3S+6OH-=2S2-+SO32-+3H2O;S2-+(x-1)S=Sx2-;SO32-+S=S2O32-;、
2Sx2-+(2x+2)SO2+(4x-2)OH-=(2x+1)S2O32-+(2x-1)H2O
(2)由关系式:S+2NaOH+SO2=Na2S2O3+H2O得:NaOH—20mol,SO2—10mol
(3)H、O、Na守衡得关系式:6NaOH+10S=2Na2S+Na2S2O3+3H2O,由S守衡得x=4