机密★启用前
高一化学上册第三次月考试题
高一化学(时间120分钟 满分 100分)
可能用到的相对原子质量:H-1,N-14,O-16,S-32,Cl-35.5,C-12,Mg-24,Cu-64, Li-7,Na-23,K-39,Ca-40,
第I卷(选择题,共60分)
一、选择题(每题只有一个答案符合题意,每题3分)
1.保护环境是每一个公民的责任。下列做法:①推广使用无磷洗衣粉 ②城市垃圾分类处理 ③推广使用一次性木质筷子 ④推广使用清洁能源 ⑤过量使用化肥、农药 ⑥推广使用无氟冰箱。其中有利于保护环境的是( )
A.①②④⑥ B.②③④⑥ C.①②④⑤ D.③④⑤⑥
2.取一小粒金属钠放在燃烧匙里加热,实验现象有下列叙述: ( )
①金属钠先熔化 ②在空气中燃烧,产生紫色火焰 ③燃烧后生成白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体。
其中描述正确的是( )
A.①② B.①②③ C.①④⑤ D.④⑤
3.在强酸溶液中,下列各组离子能够大量共存的是( )
A. Mg2+、Ca2+、HCO3-、Cl- B. Na+、PO43-、Cl-、SO42-
C K+、Fe2+、SO42-、Br- D. Fe3+、Ca2+、Cl- 、OH-、
4.下列关于Na2O2的叙述正确的是( )
A .Na2O2是淡黄色固体,久置于空气中变成Na2O
B. Na2O2与水的反应中,Na2O2只作氧化剂
C. 用Na2O2漂白过的织物、麦杆等日久又渐渐变成黄色
D. Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出
5.下列反应的离子方程式,书写错误的是 ( )
A. 硫酸氢钠溶液与氢氧化钠溶液:H++OH-=H2O
B.碳酸氢钙溶液与足量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O ;
C. 钠与水:2Na+2H2O=2Na++2OH-+H2↑
D. 小苏打与盐酸:HCO3-+H+=CO2↑+H2O
6. 设NA代表阿伏加德罗常数,下列说法正确的是( )
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.常温常压下,11.2L甲烷中含有的氢原子数为2NA
C.标准状况下,22.4 L氦气与22.4 L氢气所含原子数均为2 NA
D.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
7.将Na2O2粉末投入到下列稀溶液中,既有气体又有沉淀产生的是( )
A. NaHCO3 B. FeCl3 C. NaCl D. HCl
8.某混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的Na2O2固体,气体体积减小;最后通过灼热的铜网,经充分反应后,气体体积又减小,但还有剩余的气体。以下对混合气体组成的判断,正确的是( )
A.一定没有N2,CO和HCl中至少有一种
B. 一定有N2和CO,没有HCl
C.一定有N2和HCl,没有CO
D. 一定有N2,CO和HCl中至少有一种
9.下列关于碱金属铷(Rb)的叙述中,正确的是( )
A.灼烧氯化铷时,火焰有特殊颜色
B.碳酸铷是离子化合物,不易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高
D.氢氧化铷是弱电解质
10.把CO2通入下列饱和溶液中,最终会有沉淀的是( )
A.CaCl2 B.Na2CO3 C.Ba(OH)2 D.NaHCO3
11.将由两种金属单质组成的混合物3g投入到足量的水中,放出气体0.1g,下列不可能形成此混合物的单质组是( )
A.K和Na B.Li和Na C.K和Li D.Na和Cu
12.一块表面被氧化的钠,质量是10.8g,投入水中,完全反应得到标准状况下H20.2g,则被氧化的钠的质量是( )
A.4.6g B.6.2g C.7.8g D.9.2g
13.标准状况下两个容积相等的贮气瓶,一个装有02,另一个装有CH4,两瓶气体具有相同的( )
A.质量 B.分子数 C.密度 D.原子总数
14.下列溶液中Cl-离子浓度最大的是( )
A. 65mL1mol/L的KCl溶液 B. 25mL3mol/L的NaCl溶液
C. 20mL2mol/L的MgCl2溶液 D. 10mL1.5mol/L的AlCl3溶液
15.某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个沉淀分离,加入下列离子的先后顺序正确的是( )
A.CO32- 、 Cl- 、 OH- B. Cl- 、 CO32- 、 OH-
C.OH- 、 Cl- 、 CO32- D. Cl- 、 OH- 、 CO32-
16.下列除杂所选用的试剂及操作方法均正确的一组是( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaOH(Na2CO3) | 盐酸 | - |
| B | CO2(CO) | CuO | 加热 |
| C | Fe (Zn) | 稀硫酸 | 过滤 |
| D | CO2(HCl) | Na2CO3溶液 | 洗气 |
17.在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂与还原剂的个数比为( )
A.1:1 B.1:5 C.1:8 D.1:10
18.24gSO32-恰好将1.204×1023个XO4-离子还原,则x元素在还原产物中的化合价是( )
A.+1 B.+2 C.+3 D.+4
19.下列物质中既能导电,又属于强电解质的一组物质是( )
A.石墨、醋酸溶液、食盐晶体
B. 熔融状态的KOH、熔融状态的NaCl
C. 稀H2SO4、NaOH溶液、纯HNO3
D. 液氨、石灰水、水银
20.下列有关Na2CO3和NaHCO3性质的比较中,正确的是 ( )
A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B.热稳定性Na2CO3<NaHCO3
C.常温时水溶性Na2CO3<NaHCO3
D.相对分子质量Na2CO3<NaHCO3
第Ⅱ卷(非选择题,共40分)
二、综合题
21.(8分)已知反应 ①过氧化钠与水反应 ②氧化钠与水反应
③钠与水反应 ④2F2 + 2H2O = 4HF + O2 根据上述反应,试填序号回答:
(1) 上述反应中不属于氧化还原反应的有_________.
(2) 水被氧化的有_______.
(3) 水被还原的有_______.
(4) 是氧化还原反应,但水既不被氧化、又不被还原的是________.
22.(6分)在天平的托盘上分别放置等质量的两只烧杯,烧杯内分别盛有同浓度、同体积的稀硫酸,使天平平衡,然后分别向烧杯中加入等质量的碳酸钠和碳酸氢钠,充分反应后(酸有剩余),结果天平指针偏向盛 的烧杯,其原因是 ;两烧杯中反应现象的显著差别是 。
23. (8分) 实验室配制500ml 2mol·L-1的H2SO4溶液
(1)所需仪器应该有容量瓶、玻璃棒、量筒、________________、________________。
(2)容量瓶在使用前,首先应检查 _________ 。
(3)此实验中,玻璃棒的两个作用分别是________________、________________。
(4)配制时,要用量筒量取密度为1.84g/cm3,质量分数为98%的浓硫酸_____________ml。
(5)若配好摇匀后,发现容量瓶中的液面略低于刻度线,问是否应该补充蒸馏水_____。(填“应该”或“不应该”);若所用的容量瓶中事先有少量的蒸馏水,则对实验结果有无影响。_______________。(填“有影响”或“无影响”)
24.(10分)根据下面物质间转换的框图,回答有关问题:
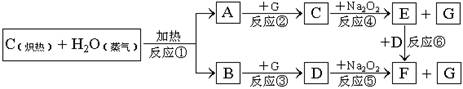
(1)写出框图中D、E的化学式:D ;E ;
(2)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积 L; 同时反应中转移电子总数是 。(NA表示阿伏加德罗常数)
(3)如果A、B混合气体7.8g(平均摩尔质量10g·mol-1),在与过量的G充分反应后,通过足量Na2O2层,可使Na2O2增重 g。
三、计算题(共8分)
25.(8分)将某碳酸钠和碳酸氢钠的混合物2.74g加热到质量不再变化时,剩余物质的质量为2.12g。
(1)求原混合物中碳酸氢钠的质量。
(2)若将原混合物溶于400ml某浓度的稀盐酸中,恰好完全反应,求该稀盐酸的HCl的质量及物质的量。
高一化学参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | C | C | D | B | D | B | D | A | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | A | B | D | D | B | B | D | B | A |
21.② ④ ③ ①
22. Na2CO3 加碳酸氢钠的烧杯放出的二氧化碳多
碳酸氢钠反应比碳酸钠剧烈
23.(1)胶头滴管、小烧杯。
(2)检验容量瓶是否漏水。
(3)搅拌,引流。
(4)54.3ml
(5)不应该;无影响。
24、(1)CO2 NaOH
(2) 22.4L 2NA
(3)7.8 g
25.(1)1.68g(2)1.46g 0.04mol