高一化学上学期1月月考试题
高一化学试卷
注意:本试卷分为第I卷和第II卷两部分。(1班、2班、3班、4班、17班、18班、19班)不做21至25、和34题;(5班、6班、7班、8班、9班、10班、11班、12班、13班、14班、15班、16班)不做26至30、和35题。
特别提醒:不要求做的题目不计分。考试时间90分钟,总分100分。
可能用到的相对原子质量:H-1,O-16,C-12,N- 14,Ca-40,Ba- 137 ,Cl-35.5,Na-23, Mg-24,Al-27, Cu-64 , Fe-56
第Ⅰ卷(选择题,共50分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共50分)
1.北京申办2008年夏季奥运会的主题之一是“绿色奥运”,要做到注重改善环境,保护环境。下列做法中不可取的是 ( )
A.加强污水处理 B.关闭所有化工企业
C.植树造林,增大绿化面积 D.降低机动车辆的尾气污染
2.下列有关0.2mol·L-1BaCl2溶液的说法不正确的是( )
A.500mL溶液中Cl-离子浓度为0.2 mol·L-1
B.500mL溶液中Ba2+离子浓度为0.2 mol·L-1
C.500mL溶液中Cl-离子总数为0.2NA
D.500mL溶液中Ba2+和Cl-离子总数为0.3NA
3.下列各组物质中,前者属于强电解质,后者属于弱电解质的一组是( )
A.CH3COOH、NH3·H2O B.Na2SO4、CO2
C.BaSO4、CH3COOH D.NaHCO3、HCl
4.在相同状况下,质量均为W g的下列气体所占的体积最小的是( )
A.CO2 B.HCl C.CH4 D. Cl2
5. 苹果汁中含有Fe2+,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由
淡绿色渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生。这说明
维生素C具有 ( )
A.氧化性 B.还原性 C.碱性 D.酸性
6. 在空气中或氧气中加热,主要生成碱性氧化物的是 ( )
A、Li B、Na C、K D、Rb
7.关于铯及其化合物的以下说法中不正确的是( )
A.氢氧化铯是一种强碱
B.铯与水或酸溶液反应都剧烈,都生成氢气
C.无水硫酸铯的化学式为Cs2SO4
D.碳酸铯加热生成氧化铯和二氧化碳
8.1.0mol·L-1的NaCl溶液表示 ( )
A.溶液中含有1 mol NaCl B.1 L水溶液里含有NaCl 58.5 g
C.58.5 g NaCl溶于941.5 g水中 D.1 mol NaCl 溶于1 L水中
9.下列离子方程式中,错误的是( )
A.氢氧化钡与稀硫酸反应: Ba2++OH-+ H++SO42-=BaSO4↓+H2O
B.碳酸氢钙跟盐酸反应:H++HCO3-=H2O+CO2↑
C.钠投入水中:2Na+2H2O=2Na++2OH-+H2↑
D.碳酸钙与醋酸溶液反应:
CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
10.Na2O与Na2O2的相同点是( )
A.都是白色固体 B.都是强氧化剂
C.都能与水反应生成碱 D.都能作为棉、毛织物的漂白剂
11.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是( )。
①Cl2+2KI = I2+2KCl ②2FeCl3+2HI = I2+2FeCl2+2HCl
③2FeCl2+Cl2 = 2FeCl3 ④I2+SO2+2H2O = 2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2 D.Cl2>Fe3+>SO2>I2
12. 在Na2O2和CO2的反应中,每生成5.6L O2(标准状况下),转移电子数为( )
A.2个 B.0.5mol C.3.01×1022个 D.0.25 mol
13.一定条件下,氨气与一氧化氮反应的方程式为:6NO + 4NH3 = 5N2 + 6H2O。在反应中氧化剂与还原剂的物质的量之比为 ( )
A.5∶6 B.4∶5 C.3∶2 D.2∶3
14.在标准状况下,m克气体A和n克气体B的分子数相同,下列说法中,不正确的是 ( )
A、 气体A与B的式量比为m:n
B、同温同压下A气体与B气体的密度比为n:m
C、同质量的A与B气体的分子个数比为n:m
D、相同状况下,同体积A气体与B气体的质量比为m:n
15.下列溶液中的c(Cl—)与50mL 1mol/LAlCl3溶液中的c(Cl—)相等是( )
A.150mL 1mol/LNaCl溶液 B.75mL 2mol/LNH4Cl溶液
C.150mL 1mol/LKCl溶液 D.75mL 1.5mol/LMgCl2溶液
16.以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.2.3g金属钠变为钠离子时失去的电子数为0.1NA
C.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
D.标准状况下,22.4L水所含分子数为NA
17. 相同物质的量浓度的AlCl3 、MgCl2 、NaCl三种溶液,分别与等物质的量的AgNO3溶液恰好完全反应,则所用去三种盐溶液的体积比为 ( )
A. 2:3:6 B. 3:2:1 C. 1:2:3 D. 6:3:2
18..将过量CO2通入到下列物质的溶液中,最终会有沉淀生成的是( )
A.NaOH稀溶液 B.饱和Na2CO3溶液
C.饱和NaHCO3溶液 D.饱和NaCl溶液
19.下列物质因强氧化性而具有漂白作用的是 ( )
A.Na2O B.NaClO C.活性炭 D. Na2O2
20.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是 ( )
A、偏二甲肼(C2H8N2)的摩尔质量为60g
B、6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C、1 mol 偏二甲肼(C2H8N2)的质量为60 g
D、6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
21.某温度下,NaOH溶液中溶质的质量分数为26.5%,溶液的密度为1.12g/cm3,求此溶液中NaOH的物质的量浓度为 ( )
A.0.15mol/L B.5.07mol/L C.1.36mol/L D.6.15mol/L
22. 已知含m g Al2(SO4)3的溶液中含a个Al3+,则阿伏加德罗常数可表示为( )
A、![]() mol-1 B、
mol-1 B、![]() mol-1 C、
mol-1 C、![]() mol-1
D、
mol-1
D、![]() mol-1
mol-1
23.已知方程式: a M2+ + 4H++bO2 = aM3+ +2H2O,则系数a的值是( )
A.1 B.2 C.3 D.4
24.实验室里需用500mL0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68g硫酸铜,加入500mL水
B.称取12.5g胆矾,配成500mL溶液
C.称取8.0g硫酸铜,加入500mL水
D.称取12.0g胆矾,配成500mL溶液
25.相同质量的Mg和Al分别跟足量稀硫酸反应,所生成的氢气在标准状况下的体积比是 ( )
A .2∶3 B.1∶1 C.3∶4 D.24∶27
26.在一定条件下,PbO2与Cr3+发生反应,产物是Cr2O72-和Pb2+,则1mol Cr3+完全反应所需PbO2的物质的量为( )
A、1.5mol B、3.0mol C、1.0mol D、0.75mol
27.20℃时,NaCl的溶解度是36g,此时NaCl饱和溶液的密度为1.12g/cm3,则此温度下NaCl饱和溶液中NaCl的物质的量浓度为
A.0.15mol/L B.1.36mol/L C.5.07mol/L D.6.15mol/L
28.下列实验过程中产生的现象与右边座标图形相符合的是 ( )
A.稀盐酸滴加到一定量NaHCO3溶液中
(横坐标是稀盐酸的体积,纵坐标为生成气体的体积)
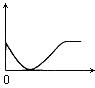 B.NaOH溶液滴入Ba(HCO3)2溶液中
B.NaOH溶液滴入Ba(HCO3)2溶液中
(横坐标是NaOH溶液的体积,纵坐标为沉淀物的质量)
C.稀盐酸滴加到AgNO3溶液中
(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
29.实验室里需用480mL0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68g硫酸铜,加入500mL水
B.称取12.5g胆矾,配成500mL溶液
C.称取8.0g硫酸铜,加入500mL水
D.称取12.0g胆矾,配成500mL溶液
30.在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温,下列说法正确的是( )
A.溶液中Na+浓度增大,有O2放出 B.溶液的OH-浓度不变,有H2放出
C.OH-浓度增大,有O2放出 D.溶液中Na+数目减少,有O2放出
班级: 姓名: 学号:
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | ||||||||||
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 |
第Ⅱ卷(非选择题,共50分)
二.填空题:(共10分)
31.高锰酸钾和氢溴酸溶液可以发生下列反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
(1)标出该反应中电子得失的方向和数目。
(2)该反应的氧化剂是: ,氧化产物是: 。
(3)若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是 mol。
(4)该反应的离子方程式是(氢溴酸是强酸)
三.推断题(共14分)
32.有一种活泼金属A,在一定条件下有如下的转化关系,已知A的焰色反应为黄色;F可使带火星的木条复燃;H能溶于盐酸生成一种能使登清石灰水变浑浊的气体。回答下列问题
|
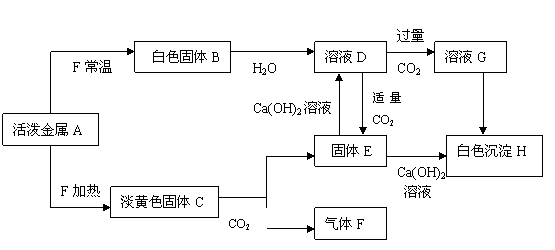

(1)写出各物质的化学式:A ; C ; E : G
(2)分别写出下列化学方程式:A→C: ;
C→E: ;D→E: 。
(3)分别写下列离子方程式:
D→G: ;G→H: 。
四.实验题(共18分)
33.某学生准备用质量分数为98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的硫酸溶液500mL。试回答下列问题:
(1)、从下列用品中选出实验所需要的仪器或用品(填序号)
A、500mL容量瓶 B、100mL烧杯 C、10mL量筒 D、100mL量筒 E、1000mL容量瓶 F、广口瓶 H、托盘天平 I、玻璃棒,除选用上述仪器外,尚缺少的仪器或用品是
(2)、容量瓶上需要标有:①温度、②浓度、③容量、④压强、⑤刻度线;五项中的( )
A.①③⑤ B.①②④ C.②③⑤ D.①②③
(3)、某学生通过计算后的实验操作如下:①用量筒量取5.2mL浓硫酸;②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;③立即将稀释后的溶液转入容量瓶中;④然后小心地往容量瓶中加蒸馏水至刻度线;⑤把容量瓶盖盖紧,再振荡摇匀。指出上述实验过程中的错误之处 。
(4)①将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是
若搅拌过程中有液体溅出,会使最终结果 (填“偏果、偏低、无影响”)
②在转入容量瓶前烧杯中液体应 ,洗涤烧杯2-3次,洗涤液也要转入容量瓶,否则会使结果 (填“偏果、偏低、无影响”)
③定容时必须使溶液液面刻度线相切,若俯视会使结果 (偏高、偏低、无影响)
五.计算题(8分)
34、(8分)将标准状况下的HCl气体4.48L溶于水形成100mL溶液,然后与足量的铁屑充分反应。计算:(1)所得盐酸溶液的物质的量浓度。
(2)参加反应的铁的质量。
(3)生成的H2的体积(标况)。
(4)将生成的FeCl2配成400 mL溶液,此溶液中FeCl2的物质的量浓度是多少?
35.(8分)在标准状况下,将224 L![]() 气体溶于635 mL(
气体溶于635 mL(![]() )的水中,所得盐酸的密度为1.20
)的水中,所得盐酸的密度为1.20![]() ,试求:
,试求:
(1)该盐酸的物质的量浓度?
(2)标准状况下,取这种盐酸200 mL与足量的![]() 溶液反应后,放出多少升气体?气体干燥后,通过盛有足量
溶液反应后,放出多少升气体?气体干燥后,通过盛有足量![]() 固体的容器,充分反应后,容器内固体增重多少克?
固体的容器,充分反应后,容器内固体增重多少克?
解:
高一化学试卷参考答案及评分标准
选择提答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | A | C | D | B | A | D | B | A | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | B | C | B | D | B | A | B | D | C |
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | B | C | D | B | C | A | C | D | B | D |
二.填空题:(每空2分,共10分)
|
|
 | |||
(2)KMnO4 , Br2 。 (3)1mol。
(4)该反应的离子方程式是: 2 MnO4- + 16 H+ +10Br - = 2Mn2+ + 5Br2 + 8 H2O
三.推断题(共14分)
32.(1)A:Na ; C:Na2O2; E:Na2CO3: G:NaHCO3 (每空1分)
(2)A→C: 2Na + O2 = Na2O2;
C→E:2Na2O2 +2CO2 = 2Na2CO3 + O2↑;
D→E:CO2 + 2NaOH = Na2CO3 + H2O。
(3)D→G:CO2 + OH- = HCO3- ;
G→H:HCO3- + Ca2+ + OH- = CaCO3 ↓+ H2O。
说明:(2)和(3)每个方程式2分,物质化学式不正确不给分,不写反应条件和不配平扣1分
四.实验题(每空2分,共18分)
33.(1) ABCI ,胶头滴管 (2) A (3) ②③④
(4)散热,防止液体飞溅(爆沸) ,偏底 , 冷却 ,偏底 , 偏高。
五.计算题(8分)
34.(1)2 mol/L;(2)5.6g ;(3)2.24L (4)0.25mol/L (每小题2分)
35.(1)12 mol/L;(3分) (2)53.76 L (2分) (3)67.2g