高一化学上学期月考试卷
命题人:王永华 时间:60分钟 满分100分
可能用到的相对原子质量:C 12 H 1 O 16 Si 28 Mg 24 Al 27 Ca 40 Fe 56
一、选择题 (只有一个选项符合题意)(共48分、每题3分)
1.下列六种工业生产:①用海水为原料制镁② 制硅酸盐水泥 ③ 制普通玻璃 ④ 冶炼生铁 ⑤制漂白粉 ⑥接触法制硫酸,用石灰石作为一种原料的是
A.①②③④⑤ B.②③④⑤⑥
C.①②③⑤⑥ D.①②③④⑤⑥
2.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝在下列使用场合须加以控制的是.①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制药片治胃病 ⑨制防锈油漆
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧ C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
3.造成大气污染的二氧化硫,最主要来源是
A.生产硫酸的工厂的尾气 B.机动车排放的尾气
C.煤和石油的燃烧 D.含硫矿石的冶炼
4.下列物质中,既能与盐酸反应又能与NaOH溶液反应的是
①Ca(HCO3)2 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤(NH4)2S ⑥Al
A.②③ B.②③⑥ C.①②③⑤⑥ D.全部
5.下列离子反应方程式正确的是
A.二氧化碳通入“水玻璃”中:CO2 + SiO32― + 2H2O == CO32―+ H4SiO4↓
B.氨水滴入AlCl3溶液中:Al3+ + 3OH― == Al(OH)3↓
C.FeO溶于稀HCl中:O![]() + 2H+ == H2O
+ 2H+ == H2O
D.Al(OH)3溶于稀H2SO4中:OH― + H+ == H2O
6. 根据下面两个化学方程式判断Fe2+、Cu2+、Fe3+ 氧化性由强到弱的顺序是
2FeCl3+ Cu = 2FeCl2+CuCl2 , CuCl2+ Fe= FeCl2+Cu
A.Fe3+ > Fe2+ > Cu2+ B.Fe2+ > Cu2+ > Fe3+
C.Cu2+ > Fe3+ > Fe2+ D.Fe3+ > Cu2+ > Fe2+
7.向某晶体的溶液中加入Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现血红色,由此得出的下列结论错误的是
A.Fe3+的氧化性比溴的氧化性强 B.该晶体中一定含有SCN-
C.Fe2+不能与SCN-形成血红色化合物 D.Fe2+被溴氧化成Fe3+
8.把Fe粉、Cu粉置于FeCl3溶液中,充分反应后加入KSCN不现红色,下列情况不能成立的是
A.铁不剩余,Cu剩余 B.铁、铜均剩余
C.铁剩余,含Cu2+ D.铜剩余,含Fe2+
9.将100mL3mol·L―1的NaOH溶液与100mL1mol·L―1AlCl3溶液按下列两种方法混合:(1)将NaOH溶液分多次加到AlCl3溶液中(边加边搅拌)
(2)将AlCl3溶液分多次加到NaOH溶液中(边加边搅拌)
上述两种实验所得正确的结论为
A.现象相同,沉淀量相等 B.现象相同,沉淀量不等
C.现象不相同,沉淀量相等 D.现象不同,沉淀量不同
10.蛇纹石由MgO、A12O3、Si02、Fe203组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是Si02
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
11.浓硫酸与下列物质反应时,既表现强酸性又表现强氧化性的是
A、赤热的木炭 B、蔗糖遇浓硫酸变黑并膨胀 C、亚硫酸钠 D、铜片
12.50 mL 18 mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量是
A.等于0.9 mol B.大于0.45 mol,小于0.9 mol
C.等于0.45 mol D.小于0.45 mol
13.把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为
A.1︰1 B.2︰5 C.4︰1 D.3︰1
14.只含SiO2杂质的石灰石样品,在高温下熔烧得到的残留物经检验为一纯净物,则原样品中SiO2的质量分数为
A.62.5% B.40% C.37.5% D.28.5%
15.将3.9g镁铝合金,投入到500mL2mol·L-1的盐酸中,金属完全溶解,再加入4mol·L-1的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是
A.125mL B.200mL C.250mL D.560mL
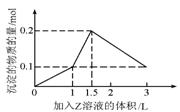 16.1L某混合溶液中,溶质X、Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol的NaOH或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化如右图所示,则X、Y 、Z分别是
16.1L某混合溶液中,溶质X、Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol的NaOH或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化如右图所示,则X、Y 、Z分别是
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
选择题答案填入下表(共48分、每题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
二、填空题(共25分)
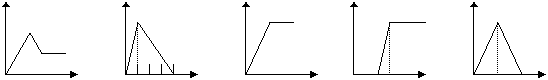 17.(共10分)下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量从A-E中选择各题要求的序号填入表中
17.(共10分)下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量从A-E中选择各题要求的序号填入表中
A B C D E
| 溶液 | 加入的物质 | 答案序号 |
| 饱和石灰水 | 通CO2至过量 | |
| AlCl3溶液 | 通过量的NH3 | |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | |
| NaAlO2溶液 | 滴加稀HCl至过量 | |
| MgCl2 AlCl3的混和液 | 滴加NaOH至过量 |
18.(共15分)物质A-J均是中学化学中常见的物质,其相互关系如图所示,已知A、B、C、D、E和F、G、H、I、J中分别含有相同的某一种元素,J物质颜色是红褐色。请填写下列空白:
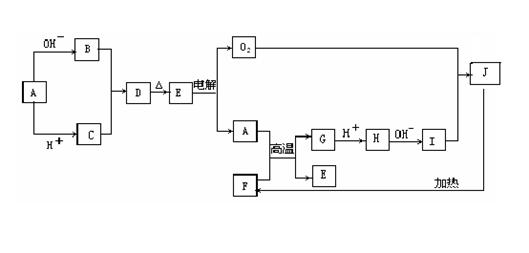 ⑴写出A和OH-反应的离子方程式
,
⑴写出A和OH-反应的离子方程式
,
B和C反应的离子方程式 ;
⑵写出A和F反应的化学方程式: ;
⑶写出I和O2反应的化学方程式: 。
暴露在空气中的现象是 。
三.实验题(共16分)
19.右下图是实验室用铜片与浓硫酸制取SO2并验证其性质的装置图。往试管Ⅰ中加入一小块铜片,再加入3~5mL 浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管Ⅱ的溶液中。
⑴若试管Ⅱ中的溶液是石蕊试液,反应一段时间后,试管Ⅱ中看到的现象是______________________________,表明生成的SO2气体水溶液具有_____性,SO2与水反应的化学方程式为:___________________________________。
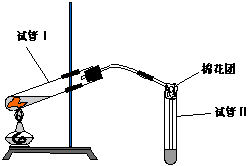 ⑵若试管Ⅱ中的溶液是品红试液,反应一段时间后,看到的现象是_____________________,说明SO2具有________性。反应充分后,取下试管Ⅱ并在酒精灯上加热,看到的现象是_______________________________
⑵若试管Ⅱ中的溶液是品红试液,反应一段时间后,看到的现象是_____________________,说明SO2具有________性。反应充分后,取下试管Ⅱ并在酒精灯上加热,看到的现象是_______________________________
⑶实验过程中,试管Ⅱ管口塞一团浸有NaOH溶液的棉花,作用是__________________,有关反应的离子方程式为:____________________________________________________。
四.计算题(共11分)
20.(本题1-8班做)电解熔融的氧化铝制取金属铝,若有0.3mol电子发生转移,则理论上能得到金属铝多少克?需氧化铝多少克?
20.(本题9-12班做)将5.1 g镁铝合金溶于60mL5.0mol/L的H2SO4溶液中,完全溶解后再加入65mL10.0mol/L的NaOH溶液,得到沉淀的质量为9.7 g,继续滴加NaOH溶液时沉淀会减少.(1)当加入_______________mLNaOH溶液时,可使溶解在硫酸中的Mg2+和Al3+恰好完全沉淀.(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积________________.
参考答案:
1-16 (共48分、每题3分) A C C C A D A C C B D D B C C C
17、(每空2分) E、C、D、B、A
18、(每空3分)(1)、2Al+2OH—+2H2O=2AlO2—+3H2↑,
Al3++3 AlO2—+6H2O=4 Al(OH)3↓
(2)、2Al+Fe2O3=2Fe+Al2O3
(3)、4Fe(OH)2+O2+2H2O= 4Fe(OH)3
白色物质迅速变成灰绿色,最后变成红褐色。
19. 略 (每空2分)
20. (本题1-8班做)2.7g (5分) 5.1g (6分)
20 . (本题9-12班做)(1)60 (5分) (2)5.6L (6分)