高一化学第二学期必修2专题单元考试卷
班级 姓名 学号 得分
可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Fe-56
一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个选项符合题意)
1.下列变化中,一定不存在化学能与热能相互转化的是( )。
A.铝热反应 B.镁条与盐酸反应 C.燃放爆竹 D.干冰气化
2.氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。氢能具有的优点包括( )①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③ C.③④ D.②④
3.下列说法正确的是( )
A.需要加热的化学反应都是吸热反应 B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
4.把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
A.盐酸的浓度 B.铝条的表面积 C.溶液的温度 D.加少量Na2SO4
5.下图各装置中,不能构成原电池的是 ( )
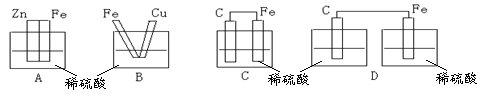
6.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是 ( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
7.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是 ( )
A.氯化钠 B.固体硝酸铵 C.固体氢氧化钠 D.生石灰
8.X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是 ( )
A.X>Y>Z B. Z>Y>X C.X>Z>Y D.Y>X>Z
9.把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl—影响反应速率的因素是
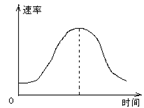
A.①④ B.③④ C.①②③ D.②③
10.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是 ( )
A.X的能量一定高于M B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
11.银锌纽扣电池,其电池的电极反应式为Zn+ Ag2O+H2O =Zn(OH)2+2Ag。据此判断氧化银是 ( )
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化
12.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g) + O2(g) = 2CO2(g); △H = —566 kJ/mol
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l); △H = —890 kJ/mol
由1molCO和3molCH4组成的混和气在上述条件下完全燃烧时,释放的热量为 ( )
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
13.反应2SO2+O2![]() 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
A.0.1 s B. 2.5 s C.5 s D.10 s
14.关于如图所示装置的叙述,正确的是( )
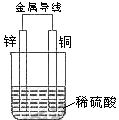
A.铜是阳极,铜片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
15.已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g) = 2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的DH = 183 kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的DH =-183 kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的DH =-183 kJ/mol
16.对于可逆反应2SO2+O2![]() 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子 ( )
2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子 ( )
A.只存在于O2中 B.只存在于O2和SO3中
C. 只存在于O2和SO2中 D.存在于O2、SO2和SO3中
17.下列措施对增大反应速率明显有效的是:
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
18.1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
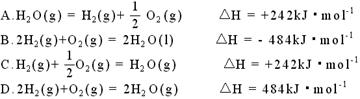
19.可逆反应2SO2 + O2 ![]() 2SO3达到平衡的标志是
2SO3达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
A.①② B.①③ C.只有③ D.只有①
20.电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是 ( )
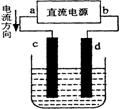
A.a为负极、b为正极 B.a为阳极、b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
第Ⅰ卷(选择题 共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷(非选择题 共40分)
二、填空题:
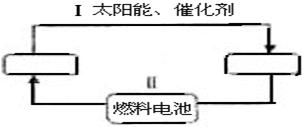
21.氢能源既是绿色能源,又可循环使用。请在下图的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转换的角度看,过程Ⅱ上应是 能转化为 能。
22.指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭 ,(2)给手机的电池充电
(3)用畜电池点亮灯泡 ,(4)电解水得到O2和H2 。
23.近年来走上街头你会发现不少公交车和出租车上有“CNG”的标志,代表它们是以天然气作为燃气的汽车。
(1) 天然气是植物残体在隔绝空气的条件下,经过微生物的发酵作用而生成的,因此
天然气中所贮藏的化学能最终来自于 。(2)天然气的主要成分是 。
(3 )天然气的主要成分是一种很好的燃料。已知4g该主要成分完全燃烧生成CO2气体
和液态水时放出222.5kJ的热量,则上述成分燃烧的热化学方程式为
24.现有如下两个反应:(A)NaOH + HCl = NaCl + H2O(B)Zn+H2SO4 = ZnSO4+ H2 ↑
(1)根据两反应本质,判断能否设计成原电池
(2)如果不能,说明其原因
(3)如果可以,则写出正、负极材料及其电极反应式,电解质溶液名称:
负极: ,
正极: , 电解质溶液:
25.可逆反应A(g)+B(g) ![]() C( g)+D(g),取a molA和b mol B置于V L容器中,1min后,测得容器内A的物质的量为x mol。这段时间内反应的平均速率若以物质A浓度变化来表示应为多少?这时B的浓度为多少?C的浓度为多少?
C( g)+D(g),取a molA和b mol B置于V L容器中,1min后,测得容器内A的物质的量为x mol。这段时间内反应的平均速率若以物质A浓度变化来表示应为多少?这时B的浓度为多少?C的浓度为多少?
参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | B | D | D | B | B | A | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | C | D | C | D | D | A | C | C |
21.化学能,电能, H2O; H2 ,O2
22.略
23.太阳能, CH4
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l); △H = —890 kJ/mol
24.(1)(A)不能,(B)可以
(2)(A)的反应非氧化还原反应,没有电子转移
(3)负极:锌,Zn — 2e- = Zn2+
正极:铜,2H+ + 2e- = H2
电解质溶液:硫酸
25.(a—x)/V mol·L—1·min—1 ;(b—a+x)/V;(a—x)/V