高一化学第二学期期中素质测试
高一化学试题
命题人:李文方 审题人:庄严
一、选择题(每小题3分,每小题只有1个选项符合题意,共54分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
1.![]() -NMR(核磁共振)可用于含碳化合物的结构分析,
-NMR(核磁共振)可用于含碳化合物的结构分析,![]() 表示的含义错误的是
表示的含义错误的是
A.表示碳元素的一种同位素 B.质量数是13,原子序数是6,核内有7个质子
C.表示碳元素的一种核素 D.质量数是13,原子序数是6,核内有7个中子
2.能源可分为一次能源和二次能源,自然界中以现成形式提供的能源称一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。据此判断,下列叙述正确的是( )。
A.天然气是二次能源 B.石油是二次能源
C.电能是一次能源 D.水力是一次能源
3.下列物质的性质比较,正确的是
A.酸性:H2SO4>HClO4>HBrO4 B.碱性:NaOH>KOH>RbOH
C.非金属性: P>S>Cl D.气态氢化物稳定性:HF>HCl>H2S
4、下列说法中,正确的是
A.原电池是利用氧化还原反应将化学能转换为电能的装置
B.由于生铁中含碳,所以比纯铁耐腐蚀
C.在原电池中,电子从正极流向负极
D.在原电池中,负极上发生还原反应,正极上发生氧化反应
5. 下列有关说法正确的是
A.第三周期的元素的原子核外都有三个电子层
B.第ⅠA族元素都是典型的金属元素
C.氟、氯、氧、氮四种元素都是第ⅦA族的元素
D.原子的最外层有两个电子的元素都在第ⅡA族
6、100 mL 6 mol·L-1 H2SO4 跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
A.碳酸钠固体 B.水 C.硫酸钾固体 D.硫酸铵固体
7. 元素X、Y可组成化学式为XY2的共价化合物,则X、Y的原子序数可能是
A.11和16 B.6和8 C.12和17 D.20和9
8、在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g) 此反应达到平衡的标志是
2Z(g) 此反应达到平衡的标志是
A.容器内气体质量不随时间变化 B. 容器内X、Y、Z的浓度之比为1︰2︰2
C. 容器内各物质的浓度不随时间变化 D.单位时间消耗0.1mol X同时生成0.2mol Z
9. 某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键
A.一定是共价键 B.一定是离子键
C.可能是共价键,也可能是离子键 D.以上说法均不正确
10、氢气在氯气中燃烧产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2KJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.Q1 + Q2 >Q3 B.Q1 + Q2 <2Q3 C. Q1 + Q2 <Q3 D.Q1 + Q2 >2Q3
11、在理论上不可用于设计原电池的化学反应是
A.Fe+CuSO4=FeSO4+Cu B.HCl+NaOH=NaCl+H2O
C.Fe + 2FeCl3 = 3FeCl2 D.CH4+2O2→CO2+2H2O
12.下列叙述正确的是
A.非金属原子间以共价键结合的物质都是共价化合物
B.含有共价键的化合物都是共价化合物
C.凡是能电离出离子的化合物都是离子化合物
D.凡是含有离子键的化合物都是离子化合物
13.实验室欲快速制取H2,应选用正确的措施是( )。
A.纯锌与稀硫酸反应 B.粗锌跟稀硫酸反应
C.粗锌跟硝酸反应 D.Zn跟浓硫酸反应
14.下列各组元素性质或原子结构的递变,叙述不正确的是
A.Na、Mg、Al原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次增大
C.Li、Na、K的电子层数依次增多
D.N、O、F得电子能力依次减弱
15.由铝、铁、铜和稀硫酸,可以组成原电池的种数是( )。
A.2种 B.3种 C.4种 D.6种
16. 元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A.左下方区域的金属元素 B.右上方区域的非金属元素
C.金属元素和非金属元素分界线附近的元素 D.稀有气体元素
17、一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷(C2H6)和氧气,其电极反应式为: C2H6+18OH--14e-=2CO32-+12H2O,
2H2O+O2+4e-=4OH-,有关此电池的推断不正确的是
A.电池工作过程中,溶液的pH值逐渐减小 B.通乙烷的电极为正极
C.正极与负极上参加反应的气体的物质的量之比为2 :7
D.正极发生还原反应
18、已知可逆反应:mA+nB![]() xC
(A,B,C均为气体)在t
s内的平均反应速率为:v(A)= a
mol/(L·s),v(B)= b mol/(L·s),v(C)= c mol/(L·s)。则x的值为
xC
(A,B,C均为气体)在t
s内的平均反应速率为:v(A)= a
mol/(L·s),v(B)= b mol/(L·s),v(C)= c mol/(L·s)。则x的值为
A bc/n B nc/b C ma/c D ac/m
二、填空题
19.(10分)A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素的最高价氧化物的水化物之间的相互反应的离子方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
。
20、(11分)
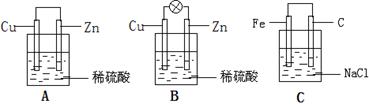
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察锌片上有气泡,再平行插入一块铜片,可观察到铜片 (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见下图A),组成一个原电池,负极为 ,正极的电极反应式为 ;
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见下图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中硫酸的物质的量浓度为(溶液体积变化忽略不计) _________ ;
(3)金属的腐蚀分为两种:化学腐蚀(与化学物质直接接触而发生化学反应)和电化学腐蚀(由于构成原电池而发生电极反应),把铁片和石墨棒用导线相连插入氯化钠溶液中(见下图C),放置数天后,主要发生 腐蚀,写出有关反应式 __________________________________________________________ ;(化学腐蚀写化学方程式,电化学腐蚀写电极反应式)
(4)生活中利用原电池原理生产了各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其主要原因是 。
A、回收利用电池外壳的金属
B、防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
 C、防止电池中渗泄的电解液腐蚀其他物品
C、防止电池中渗泄的电解液腐蚀其他物品
D、回收其中石墨电极
21(12分).⑴笑气(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为 ,由此可知它 (填“含有”或“不含”)非极性键。
⑵、在NaCl、NaOH、N2、H2S中,
只含有离子键的是 ,只含有极性键的是 ,
只含有非极性键的是 ,既含有离子键又有极性键的是 。
⑶、下列各题中有关物质的比较,请用“>”、“<”、“=”填空:
①熔沸点: F2 Cl2 HF HCl;
②氧化性: F2 S, N2 O2;
③热稳定性:CH4 NH3, HCl HI。
22、.⑴(5分)在下列事实中,什么因素影响了化学反应的速率?
①夏天的食品容易霉变,冬天就不容易发生该现象 ;
②熔化的氯酸钾放出气泡很慢,撒入少量二氧化锰很快产生气体 ;
③工业上常将固体燃料粉碎,以提高燃烧效率 ;
④同浓度的硫酸和盐酸与大小且质量相同的锌粒反应,产生气体硫酸快、盐酸慢 ;
⑤集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸 。
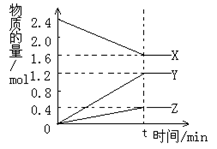 ⑵(8分)在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如右图。反应在t时到达平衡,依图所示:
⑵(8分)在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如右图。反应在t时到达平衡,依图所示:
①该反应的化学方程式是 。
②反应起始至t,Y的平均反应速率是 。
③X的物质的转化率是__________________。
④关于该反应的说法正确的是_________
A.到达t时刻该反应已停止;
B.在t时刻之前X的消耗速率大于它的生成速率;
C.在t时刻正反应速率等于逆反应速率;
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等。
参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | D | A | A | B | B | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | D | B | D | B | C | D | B |
19. (1)A:Na, B:Al, C:Si, D:P, E:S (每空1分,共5分)
![]() (2)
(2)
(2分)
(3)Al(OH)3+ OH- === AlO2-+2H2O (2分)
(4)H3PO4>H2SiO3 (1分)
20. (1)没有 锌 2H++2e-=H2 (2) 0.5mol/L
(3) 电化学腐蚀 O2+4e-+2H2O=4OH- (4)B
![]() 21.(1) , 含有
21.(1) , 含有
⑵、NaCl、H2S、 N2、 NaOH
(3)①< > ② > < ③< >
22.⑴ ①温度 ②催化剂 ③固体表面积 ④H+的浓度 ⑤光照
⑵ ①2X=3Y+Z ②0.6/t mol/(lm) ③33.3% ④BC