高一化学第二学期期中考试
(必修)试卷
命题: 审题:
注意:1.试卷满分:100分 答题时间:75分钟
2.请将答案填写在答题纸上
3.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24
Al 27 S 32 Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 Zn 65
(第I卷选择题 共65分)
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个正确选项)
1.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”, 它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是( )
A.同一种物质 B.同分异构体
C.同位素 D.同素异形体
2.科学家发现了一种新元素,它的原子核内有161个中子,质量数为272,该元素的原子序数为( )
A.111 B.161 C.272 D.433
3.下列化学反应属于吸热反应的是( )
A.NH4Cl与Ba(OH)2·8H2O研磨 B.生石灰溶于水
C.镁与稀盐酸反应 D.甲烷燃烧
4.下列各组物质按酸、碱、盐分类顺次排列正确的是 ( )
A.硫酸、纯碱、石膏 B.氢硫酸、烧碱、明矾
C.硝酸、乙醇、醋酸钠 D.磷酸、熟石灰、苛性钾
5.下列描述正确的是( )
A.含有共价键的化合物一定是共价化合物
B.离子化合物中只能含有离子键
C.气体分子中都含有化学键
D.离子化合物中可能含有共价键
6.下列化合物中,既有离子键又有共价键的是( )
A.NH4Cl B.MgO C.C2H6 D.CO2
7.1868年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是( )
A.元素周期表有七个周期 B.元素周期表有18个族
C.IA族的元素全部是金属元素 D.短周期是指第一、二、三、四周期
8. 下列说法不正确的 ( )
A.甲烷是一种难溶于水的气体
B.天然气是一种高效、低耗、污染小的清洁能源
C.甲烷分子是一种对称的正四面体结构,四个C—H键强度相同
D.甲烷不与任何物质反应
9.下列实验仪器不宜直接用来加热的是( )
A.试管 B.坩埚 C.蒸发皿 D.烧杯
10.下列反应中,不属于氧化还原反应的是 ( )
|
|
|
C.CaO + H2O ==== Ca(OH)2 D.CuO + H2 ===== Cu + H2O
11.下列除杂质选用试剂和主要操作都正确的是 ( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| C | I2 | H2O | 乙醇 | 萃取 |
| D | H2O | Fe3+ | NaOH | 过滤 |
12. 下列关于烃的说法中,正确的是( )
A.烃是指分子里含有碳、氢元素的化合物
B.烃是指分子里含碳元素的化合物
C.烃是指燃烧反应后生成二氧化碳和水的有机物
D.烃是指仅由碳和氢两种元素组成的化合物
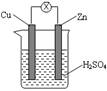 13.如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。下列叙述正确的是( )
13.如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。下列叙述正确的是( )
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能
14.已知某酸性溶液中含有Ba2+、Fe3+,则下列能与上述离子共存的离子组是 ( )
A.CO32—、SO42—、NH4+、Na+ B.OH—、SCN—、NO3—、Cu2+
C.Cl—、Br—、I—、Mg2+、Na+ D.H+、Cl—、NO3—、Al3+
15.在元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制( )
A.合金 B.半导体 C.催化剂 D.农药
二、选择题(本题共5小题,每小题4分,共20分。每小题只有一个正确选项)
16.将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,生成物中产量最大的是( )
A.CH3Cl B.CH2Cl2 C.CCl4 D.HCl
17.改变下列条件,化学反应速率不一定改变的是( )
A.温度 B.压强 C.浓度 D.催化剂
18.下列对于Na、Mg、Al的有关叙述中,正确的是( )
A.离子氧化性:Na+>Mg2+>Al3+ B.原子半径:Na<Mg<Al
C.碱性:NaOH>Mg(OH)2>Al(OH)3 D.单质的还原性:Na<Mg<Al
19. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率![]() (X) (反应物的消耗速率或产物的生成速率)可表示为( )
(X) (反应物的消耗速率或产物的生成速率)可表示为( )
A.![]() (NH3)=0.0060 mol/(L·s) B.
(NH3)=0.0060 mol/(L·s) B.![]() (NO)=0.0040
mol/(L·s)
(NO)=0.0040
mol/(L·s)
C.![]() (O2)=0.0060
mol/(L·s) D.
(O2)=0.0060
mol/(L·s) D.![]() (H2O)=0.036
mol/(L·min)
(H2O)=0.036
mol/(L·min)
20.有Mg、Al混合粉末10.2g,将它溶于500mL 4mol·L-1的盐酸里,若要使沉淀质量达到最大值,则需加入2mol·L-1氢氧化钠溶液的体积为( )
A.1500mL B.1000mL C. 500mL D.100mL
(第II卷非选择题 共35分)
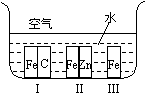 21.(2分)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
21.(2分)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
22. (4分)对于混合物的分离或提纯,常采用的方法有;过滤、蒸发、蒸馏、萃取、渗析、加热分解等。下列各组混合物的分离或提纯应采用什么方法?
(1) 实验室中的石灰水久置,液面上常浮有CaCO3微粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)除去氧化钙中的碳酸钙可用 方法。
![]() 23.(6分)在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,
23.(6分)在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,
已知A、B、C中均含有同一种元素,D为非金属单质。
⑴ 若A为气体单质,C与水反应所得的溶液呈酸性,则A的分子式为 ,常温常压下C的颜色为 。
⑵ 若A为固体单质,C能使澄清石灰水变浑浊。写出B与D生成C的方程式 。
24.(12分)A、B、C为金属单质,甲、乙、丙为气体,D、E、F、G、H为中学化学中常见的物质,它们之间有下列转化关系,如图所示:(图中有些反应的产物和条件没有完全标出)
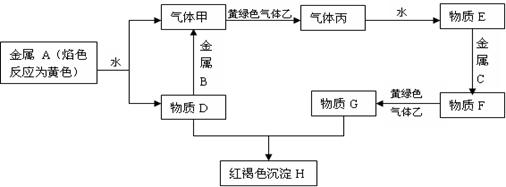 |
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙: E: 。
![]() (2)写出A+H2O 甲+D的化学反应方程式:
。
(2)写出A+H2O 甲+D的化学反应方程式:
。
![]() (3)写出D+B 甲+?的化学反应方程式:
。
(3)写出D+B 甲+?的化学反应方程式:
。
![]() (4)写出F+乙 G+?的离子反应方程式:
。
(4)写出F+乙 G+?的离子反应方程式:
。
![]() (5)写出D+G H+?的离子反应方程式:
。
(5)写出D+G H+?的离子反应方程式:
。
25.(13分)有A、B、C、D四种短周期元素,它们的原子序数依次增大。A是自然界中相对原子质量最小的元素,B是地壳中含量最高的元素,D则是地壳中含量最高的金属元素,C与A同主族、与D同周期。
⑴ 写出A和D的元素符号 、 。
⑵ A2B属于 化合物。(填“离子”或“共价”)
⑶ C和D的原子半径 C D。C和D的金属性C D。(填“>”、“=”或“<”)
⑷写出由A、B、C三种元素形成化合物的电子式
⑸用电子式表示化合物A2B的形成过程:
⑹将2.7 g D单质溶于200 mL 1 mol·L-1的NaOH溶液中,计算生成的气体在标准状况下的体积为多少升?
高一化学第二学期期中考试
![]()
 化学(必修)试卷答题纸
化学(必修)试卷答题纸
一、选择题(本题共15小题,每小题3分,共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
二、选择题(本题共5小题,每小题4分,共20分。)
| 题号 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
26.(5分)
(1)25
(2)胶头滴管 250mL容量瓶
(3)2.6 0.2mol/L