高一化学第二学期期中考试测试卷
(试卷满分:100分 测试时间:90分钟)
第I卷(选择题 共69分)
一、(本题包括23小题,每题只有有1个正确答案,每题3分,共69分)
1.下列科学家中,绘制第一张元素周期表的是:
A.道尔顿B.门捷列夫C.拉瓦锡D.舍勒
2.现行元素周期表中,元素种类最多的周期是:
A.第4周期B.第5周期C.第6周期D.第7周期
3.613C-NMR(核磁共振)可以用于含碳化合物的结构分析。613C表示的碳原子:
A.核外有13个电子,核内有7个中子
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
4.下列事实中,能说明钾的金属性比钠强的是:
A.钾与水反应比钠与水反应剧烈
B.钾的密度比钠小
C.NaOH的碱性比KOH强
D.钾比钠更容易切割
5.下列离子中,其核外电子排布与氩原子核外电子排布不同的是:
A.Mg2+ B. S2- C. K+ D.Cl-
6.下列各组微粒中,按微粒半径依次增大排列的是:
A. Al3+ Al Na K B. F Cl S2- S
C.S2- Cl- K+ Ca2+ D.Mg Si P K
7.下列元素中,最高价氧化物对应的水化物的酸性最弱的是:
A.Cl B.S C.N D.P
8.下列氢化物中,稳定性最差的是:
A.NH3 B.PH3 C.HF D.H2O
9.在元素周期表的金属元素和非金属元素交界处,最容易找到的材料是:
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.制半导体的材料
10.下列物质中,属于共价化合物的是:
A.Na2O2 B.NaHSO4 C.HNO3 D.I2
11.下列比较关系中,错误的是:
A.元素金属性 Na>Mg>Al B.热稳定性 H2S<HCl<HF
C.酸性 H3PO4<H2SO4<HClO4 D.原子半径Mg>Na>H
12.不能用来比较元素非金属性强弱的条件是:
A.最高价氧化物对应水化物的酸性强弱 B.气态氢化物的稳定性
C.非金属间的相互置换反应 D.单质的溶、沸点高低
13.下列说法正确的是:
A.形成化学键要吸收能量
B.放热反应在常温条件下都很容易发生
C.反应是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小
D.断开反应物中的化学键要放出能量
14.厄尔尼诺现象产生的原因之一是大气中二氧化碳的含量剧增,要想减缓这一现象的发生,最理想的燃料是:
A.天然气 B.氢气
C.无烟煤 D.汽油
15.能源可分为一次能源和二次能源,自然界中以现成形式提供的能源称一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。据此判断,下列叙述正确的是:
A.天然气是二次能源 B.石油是二次能源
C.电能是一次能源 D.水力是一次能源
16.埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀速率最小的是:
A.在含铁元素较多的酸性土壤中
B.在潮湿疏松透气的土壤中
C.在干燥致密不透风的土壤中
D.在含碳粒较多、潮湿透气的中性土壤中
17.为了保护地下钢铁制品不被腐蚀,可以采用的方法是:
A.跟钢板相连
B.跟铅板相连
C.跟金属锌相连
D.把钢铁切成小块
18.将镁条投入到盛有盐酸的敞口容器中,产生H2的速率先增大后变小,
下列因素中,影响反应速率的是
①盐酸的浓度②镁条的表面积③溶液的温度④Cl-的浓度
A.①④ B.③④
C.①②③ D.②③
19.燃料不充分燃烧引起的主要后果有
①产生温室效应②能源的浪费③环境污染④锅炉爆炸
A.①② B.②③
C.③④ D.②④
20.下列各组的电极材料和电解液,不能组成原电池的是:
A.铜片、石墨棒,稀硫酸 B.铜片、石墨棒,硝酸银溶液
C.锌片、铜片,稀硫酸 D.铜片、银片,氯化铁溶液
21.等质量的下列烃完全燃烧时,消耗氧气最多的是:
A.CH4 B.C2H6
C.C3H6 D.C6H6
22.除去乙烷中乙烯的简便方法是:
A.加入氢气和乙烯反应 B.通过溴水
C.通过浓硫酸 D.通过水
 23.是谁第一个想到苯是环状结构的:
23.是谁第一个想到苯是环状结构的:
A.拉瓦锡 B.维勒
C.阿佛加德罗 D.凯库勒
第II卷(非选择题 共31分)
二、(本题包括5小题,共31分)
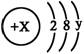 24. 某简单微粒的结构示意图为:且X、Y 均为不大于20的正整数,据此回答下列问题:
24. 某简单微粒的结构示意图为:且X、Y 均为不大于20的正整数,据此回答下列问题:
(1)若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是
(2)若该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为
(3)若该微粒为一价阳离子,且对应的碱为可溶性强碱,则x= y= 。
25.在下列事实中,什么因素影响了化学反应的速率?
①夏天的食品容易霉变,冬天就不容易发生该现象 ;
②熔化的氯酸钾放出气泡很慢,撒入少量二氧化锰很快产生气体 ;
③工业上常将固体燃料粉碎,以提高燃烧效率 ;
④同浓度的硫酸和盐酸与大小且质量相同的锌粒反应,产生气体硫酸快、盐酸慢 ;
⑤集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸 。
26.下表是元素周期表的一部分,回答下列有关问题;
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 |
|
|
|
| ① |
| ② |
|
| 3 | ③ | ④ | ⑤ | ⑥ |
| ⑦ | ⑧ | ⑨ |
| 4 | ⑩ | ⑾ |
|
|
|
| ⑿ |
|
(1)写出下列元素符号:①___________,⑥____________,⑦_________,⑾______________。
(2)在这些元素中,最活泼的金属元素是_________,最活泼的非金属元素是___ ___,最不活泼的元素是______________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________ ______,碱性最强的是______________,呈两性的氢氧化物是______________,写出三者之间相互反应的化学方程式。 、 、
(4)在这些元素中,原子半径最小的是____________,原子半径最大的是_____________。
(5)在③与④中,化学性质较活泼的是______________,怎样用化学实验证明______________。
(6)在⑧与⑿中,化学性质较活泼的是______________,怎样用化学实验证明?答:______________。
27.如下图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
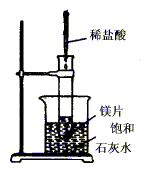
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”)镁片和盐酸的总能量。
28.城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它有煤炭与水蒸气在高温下反应制得,故又称水煤气。试回答:
(1)写出制取水煤气的主要化学方程式 ,该反应是 反应(填吸热、放热)。
(2)设液化石油气的主要成分为丙烷(C3H8),其充分燃烧后产物为C02和H2O,试比较完全燃烧等质量的C3H8及CO所需的氧气的质量比为: 。
 第二学期期中考试测试卷
第二学期期中考试测试卷
高一化学 答案卷
一、(本题包括23小题,每题只有有1个正确答案,每题3分,共69分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | ||||||||||
| 题号 | 21 | 22 | 23 | |||||||
| 答案 |
二、(本题包括5小题,共31分)
24. (1)
(2)
(3) x= y= 。
25. ① ;
② ;
③ ;
④ ;
⑤ 。
26. (1)①___________,⑥____________,⑦_________,⑾______________。
(2) _________, ___ ___, ______________。
(3) _______ _____, _____ _________, _____ _ ____,
、
、
(4) ____________, _____________。
(5) ______________, ____ __________。
(6) ______ ________, _______ _______。
27.(1)
(2)
(3)
(4)
28. (1) ,
(2) 。

高一化学 答案卷
一、(本题包括23小题,每题只有有1个正确答案,每题3分,共69分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | D | A | A | A | D | B | D | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | D | C | B | D | C | C | C | B | A |
| 题号 | 21 | 22 | 23 | |||||||
| 答案 | A | B | D |
二、(本题包括5小题,共31分)
24. (1) Ar
(2) Cl的原子结构示意图
(3) x= 11 y= 1 。
25. ① 温度 ;
② 催化剂 ;
③ 接触面积 ;
④ H+的浓度 ;
⑤ 接触面积 。
26. (1)①___N_____,⑥_____Si_______,⑦____S____,⑾_______Ca_______。
(2) ___K__ ____, ___ F ___, _______ Ar _______。
(3) _____HClO4__ _____, _____ KOH _______, ____ Al(OH)3_ ____,
_HClO4 + KOH ====== KClO4 + H2O 、
Al(OH)3 + KOH ======KAlO2 + 2H2O 、
3HClO4__ + Al(OH)3 ====== Al(ClO4)3 + 3H2O
(4) ______F______, ______K_______。
(5) _______③_______, ____ 分别与水反应 。
(6) _____ ⑧ ___, ______与H2化合的难易程度_ _______。
27.(1) 镁片上有大量气泡产生,镁片逐渐溶解,烧杯中析出晶体
(2) 镁与盐酸反应产生氢气,该反应为放热反应,氢氧化钙在水中的的溶解度随温度的升高而减少,故析出氢氧化钙晶体
(3) Mg + 2H+ ====== Mg2+ + H2 ↑
(4) 小于
|
28. (1) C + H2O ====== CO + H2
吸热
(2) 70:11 。