高一年级化学科第一学期学段考试试题卷
第I卷(55分)
相对原子质量:O:16; S:32; N :14; Na :23; Fe :56;
Ba:137; Cl :35.5; K :39; C :12; Al: 27; H:1
一.单项选择(每题只有一个正确答案,每小题2分,共40分)
1.将下列各组物质按酸、碱、盐顺序排列,正确的是:
A.硫酸、纯碱、石灰石 B.醋酸、酒精、醋酸钠
C.亚硫酸、火碱、小苏打 D.磷酸、熟石灰、苛性钾
2.下列说法正确的是
A、纯净物一定由分子构成
B、同种分子构成的物质一定是纯净物
C、混合物肯定由两种以上元素组成
D、含有氧元素的化合物都是氧化物
3.下列仪器中,具有能溶解固体、配制溶液、加热较多试剂三种用途的是
A.容量瓶 B.烧杯 C.量筒 D.试管
4.下列的分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
5.在盛有碘水的试管中,加入适量CCl4后充分振荡,静置后
A.整个溶液变紫色 B.整个溶液变为棕黄色
C.上层为无色,下层为紫红色 D.下层无色,上层紫红色
6.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 。正确的操作顺序是
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
7.某同学在实验报告中有以下实验数据:①用托盘天平称取11.7 g食盐;②用量筒量取5.26 mL盐酸;③用广泛pH试纸测得溶液的pH值是3.5,其中数据合理的是
A.① B.②③ C.①③ D.②
8.下列叙述正确的是
A、48gO3气体含有6.02×1023个O3分子
B、常温常压下,4.6gNO2气体含有1.81×1023个NO2分子
C、0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D、标准状况下,33.6LH2O含有9.03×1023个H2O分子
9.下列反应既是离子反应,又是氧化还原反应的是
A.氯化钠溶液中滴入硝酸银溶液 B.金属钠在氯气中燃烧
C.铁片置于硫酸铜溶液中 D.氢氧化钠溶液与稀硫酸反应
10.下列物质的水溶液能导电,但属于非电解质的是
A.CH3CH2COOH B.Cl2 C.NH4HCO3 D.SO2
11.下列反应的离子方程式正确的是
A.氨气通入醋酸溶液: CH3COOH+NH3=CH3COONH4
B.澄清的石灰水与盐酸反应:H++OH—=H2O
C.碳酸钡加入稀硫酸:BaCO3+2H+=Ba2++H2O+CO2↑
D.碳酸钠与盐酸等物质的量反应:CO32-+2H+=H2O+CO2↑
12.能在溶液中大量共存的一组离子是
A.Cu2+、SO42-、OH—、K+ B.Na、CO32-、H+、Cl-
C.H+、Cl-、NO3-、Ba2+ D.Ca2+、H+、CO32-、NO3-
13.下列溶液的c(Cl-)与50 mL 1 mol·L-1的AlCl3溶液c(Cl-)相等的是
A、150 mL 1 mol·L-1的NaCl B、75 mL 3 mol·L-1的NH4Cl
C、75 mL 2 mol·L-1的MgCl2 D、100 mL 2mol·L-1的FeCl3
14.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
①Cl2+2K I =I2+2KCl ②2FeCl3+2HI=I2+2FeCl2+2HCl
③2FeCl2+Cl2=2FeCl3 ④I2+SO2+2H2O=2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2 D.Cl2>Fe3+>SO2>I2
15.在NaCl、MgCl2、MgSO4三种盐配制的混合液中,Na+为0.1 mol, Mg2+为0.25 mol,Cl— 为0.2 mol,则SO42 - 为
A、0.5 mol B、0.15 mol C、0.25 mol D、0.2 mol
16.下列变化中,必须加入氧化剂才能发生的
A. SO2→S B. SO32-→SO2 C. I-→I2 D. HCO3-→CO32-
17.对于相同物质的量的SO2和SO3,下列说法中正确的是
A.氧元素的质量比为1∶1 B.分子数之比为1∶1
C.原子总数之比为1∶1 D.质量之比为1∶1
18.下列叙述与胶体的性质无关的是
A.同一支钢笔使用不同品牌墨水时,容易发生堵塞现象
B.当日光从窗隙射入暗室时,可观察到一束光线
C.向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深
D.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
19.从浓度为98%,密度为1.84g/cm3的浓硫酸中取出100mL,然后稀释到1L,则所得溶液的物质的量浓度是
A、0.0184mol/L B、0.184 mol/L
C、1.84 mol/L D、18.4 mol/L
20.氢化钙中的氢元素为—1价,它可用做生氢剂,反应的化学方程式是:CaH2+2H2O==Ca(OH)2+2H2↑。该反应中,水的作用是
A.溶剂 B.还原剂 C.氧化剂 D.既是还原剂又是氧化剂
二、多选题(每小题有1或2个选项,每题3分, 漏选1分,共15分)
21.下列说法中,正确的是:
A.O2的摩尔质量与NA个O2分子的质量在数值上相等
B.0.1 mol/L CaCl2 溶液中,含有2NA 个Cl—
C.足球烯C60 的摩尔质量是720g
D.标准状况下,1mol H2O 的质量是18 g
22.实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。实验员选择了一种试剂分别滴入三种试剂样品中,就把它们区别开来了,这种试剂是:
A.盐酸 B.氢氧化钠溶液 C.氯化钡溶液 D.硝酸
23.实验室里需用500mL 0.1 mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g胆矾配成500 mL溶液
24.等体积硫酸铝,硫酸锌,硫酸钠溶液分别与足量氯化钡溶液反应.若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐溶液的物质的量浓度比为
A.1∶2∶3 B. 1∶3∶6 C.1∶3∶3 D. 1∶6∶9
25.在酸性溶液中(加热并有Ag+催化)可发生反应:
2Mn2++5R2O8x-+8H2O=16H++10RO42-+2MnO4-,根据上述反应,则R2O8x-中x的值是:
A.4 B.3 C.2 D.1
第II卷(共45分)
三、填空题(共28分)
26.(3分)写出下列物质在水溶液中的电离方程式
硫酸铝
碳酸
27.(6分)写出下列反应的离子方程式
(1)硫酸铜溶液与氢氧化钠溶液混合
(2)碳酸钠溶液与过量稀盐酸混合
(3)过量CO2通入澄清石灰水中:
28.(3分)49g硫酸是 molH2SO4,含有 mol O,含有 个氢原子。
29.(4分) 甲、乙、丙、丁、戊分别是Na2SO4、Ba(NO3)2、HNO3、BaCl2、NaOH五种溶液中的一种,现利用某X溶液鉴别它们,根据下图关系回答问题:
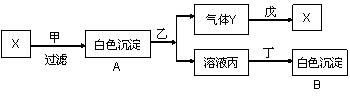
写出下列物质的化学式:丙___________、丁____________
30、(6分)配平下列方程式
□As2O3+□HNO3+□H2O ― □H3AsO4+□NO
在该反应中氧化剂是________,氧化产物是_________。每1mol HNO3参与反应,转移电子数为_____ mol。
31.(2分)用双线桥标出下列方程式中电子转移情况:
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
四.实验题(20分)
32.(5分)对于混合物的分离或提纯,常采用的方法有:分馏、蒸发、蒸馏、萃取、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
(1)分离石油中的汽油和柴油,用 方法。
(2)提取碘水中的碘,用 方法
(3)除去食盐溶液中的水,可采用 的方法。
(4)海水淡化,可采用 的方法。
(5)除去氧化钙中的碳酸钙可用 的方法。
33.(2分)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm—3 | 溶解性 |
| A | —11.5 | 198 | 1.11 | A、B互溶, 且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是: (填“过滤”、“蒸发”、“萃取”、“分液”、“蒸馏”等)
34.(3分)请把下面一些常用危险化学药品的标志贴在对应的化学药品瓶子上(在横线上写上编号即可)。
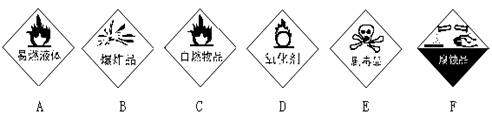
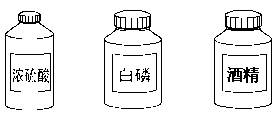
______ ______ ______
35.(8分)实验室用氯化钠固体配制0.10mol/L的NaCl溶液450mL,回答下列问题
(1)请写出该实验的实验步骤,并回答:
①计算
②称量:应称量 g固体氯化钠。
③溶解:所需仪器 。(2分)
④转移:将烧杯中的溶液沿玻璃棒小心地引流到容量瓶中。
⑤洗涤
⑥定容:向容量瓶中加入蒸馏水,到液面离容量瓶刻度线下1-2cm,改用胶头滴管加蒸馏水至液面与刻度线相切。
⑦ 摇匀。
(2)试分析下列操作对所配溶液的浓度有何影响。(填“偏高”、“偏低”或“没影响” )
①.摇匀后,液面低于刻度线,没有再加水;
②.移液过程中,不小心溅出少量溶液;
③.配制用的NaCl固体不纯净;
④.定容时,俯视刻度线;
五、计算题(5分)
36.已知HCl与NaOH完全中和时,两者的物质的量之比为1∶1。现有某NaOH溶液100mL,其中含溶质8g,加水将该氢氧化钠溶液稀释至1000mL,取稀释后的NaOH溶液500mL,恰好与100mL的盐酸完全反应,试求这种盐酸溶液溶质的物质的量浓度。
高一年级化学科试题参考答案
一、二、选择题:(共55分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | B | C | C | A | A | A | C | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | C | B | C | D | C | B | D | C | C |
| 21 | 22 | 23 | 24 | 25 | |||||
| AD | A | D | D | C |
三、填空题(共22分)
26.(3分)Al2(SO4)3=2Al3++ 3SO42-
H2CO3 ![]()
![]() H+ + HCO3- HCO3-
H+ + HCO3- HCO3-
![]()
![]() H++CO32-
H++CO32-
27.(每空2分)Cu2++2OH-==Cu(OH)2↓ CO32-+2H+ = H2O + CO2↑
CO2+OH-==HCO-3
28.(每空1分)0.5mol 2 mol 6.02×1023
29.(4分)(1)Ba(NO3)2 Na2SO4
30.(8分)3As2O3+4HNO3+7H2O = 6H3AsO4+4NO
HNO3,H3AsO4。3mol
31.(2分)
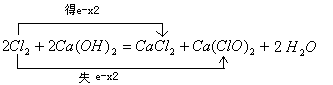
四、实验题(18分)
32.(5分)(1)分馏(2)萃取(3)蒸发(4)蒸馏(5)加热分解
33.(2分)蒸馏
34.(3分) F C和E A
35.(8分)
(1)②2.9 ,(2分)③烧杯、玻璃棒,(2分)
(2)不变,偏低,偏低,偏高(每空1分)
五、计算题
36.(5分)根据稀释前后,溶质的物质的量不变可得,稀释后的NaOH溶液500mL中含NaOH的物质的量为:
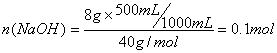 (3分)
(3分)
根据题意可知,100mL的盐酸中所含溶质HCl的物质的量也为0.1mol,所以盐酸溶液溶质的物质的量浓度为:
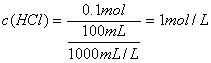 (2分)
(2分)
答:所求盐酸溶液溶质的物质的量浓度为1mol/L。
高一年级化学科答题卷
三、填空题(共22分)
26.
27.(1)
(2)
(3)
28. , ,
29. ,
30. □As2O3+□HNO3+□H2O ― □H3AsO4+□NO (2分)
, . .
31. 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
四、实验题(18分)
32.(1) (2) (3)
(4) (5)
33.
34.
35.(1)② ,③
(2) , , ,
五、计算题
36.