高一年级化学第一学期期中考试试卷
化 学
可能用到的相对原子质量:H:1 C:12 O:16 Na:23 N:14
一、选择题(本题共6小题,每题只有一个选项是符合题意,请把正确答案填在答案纸上。每小题3分,共18分)
1.下列仪器中,具有能溶解固体、配制溶液、加热较多试剂三种用途的是
A.容量瓶 B.烧杯 C.量筒 D.试管
2.在下列物质分类中,前者包括后者的是
A.氧化物 化合物 B.化合物 电解质 C.溶液 胶体 D.溶液 分散系
3.等质量的下列物质所含分子数最多的是
A.H2 B.O2 C. N2 D.CO2
4.下列的分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
5.胶体区别于其他分散系的本质特征是:
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
6、下列各组中的离子,能在溶液中大量共存的是
A.K+、Mg2+、NO3-、Cl- B.Ba2+、Na+、CO32-、 OH-
C.Mg2+、Ba2+、OH-、NO3- D.H+、 K+、 CO32-、 SO42-
二、选择题(本题共8小题,每题只有1--2个选项是正确的,请把正确答案填在答案纸上。每小题4分,共32分)
7、下列实验操作错误的是
A.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处。
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上
D.如果没有试管夹,可以临时手持试管给固体或液体加热
8、设![]() 为阿伏加德罗常数,下列说法中正确的是( )
为阿伏加德罗常数,下列说法中正确的是( )
A.![]() 个氢气分子所占的体积为22.4L
个氢气分子所占的体积为22.4L
B.![]() 个二氧化碳分子的质量为88g
个二氧化碳分子的质量为88g
C.0.1mol/L 的NaCl溶液中,![]() 与
与![]() 离子总数为
离子总数为![]()
D.17g NH3中所含原子数为4![]()
9、下列叙述正确的是
A.化合反应一定是氧化还原反应
B.凡是两种或两种以上的物质发生的反应就属于化合反应
C.物质只有和氧气发生化合反应才是氧化反应
D.镁条在空气中燃烧既属于化合反应又属于氧化还原反应
10、氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
![]() Al2O3
+ N2 + 3C
2AlN + 3CO
Al2O3
+ N2 + 3C
2AlN + 3CO
下列有关该反应的叙述不正确的是
A.氮化铝中氮元素的化合价为-3
B.上述反应中,电子转移的数目为6mol
C.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
D.该反应不属于四种基本反应类型中任一种
11、等体积的空气和二氧化碳混和,并使之在高温下跟足量的焦炭反应,若氧气和二氧化碳最后全部转化成一氧化碳,则反应后的气体中一氧化碳的体积分数约是
A.0.60 B.0.64 C.0.70 D.0.75
12、为除去粗盐中的Ca 2+、Mg 2+、SO4 2-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液 正确的操作顺序是
A、①④②⑤③ B、④①②⑤③
C、②⑤④①③ D、⑤②④①③
13、配制500mL1.0mol/L的NaCl溶液时,下列操作会使实际浓度偏高,偏低还是不变的判断中正确的是:
A、摇匀后,液面低于刻度线,没有再加水; 偏低
B、移液过程中,不小心溅出少量溶液; 偏低
C、配制用的NaCl固体不纯净; 不变
D、定容时,俯视刻度线; 偏高
14、 若以![]() 表示CO2的摩尔质量,v表示在标准状态下CO2的摩尔体积,ρ为在标准状态下CO2的密度,NA为阿伏加德罗常数,m、△分别表示每个二氧化碳分子的质量和体积,下面是四个关系式
表示CO2的摩尔质量,v表示在标准状态下CO2的摩尔体积,ρ为在标准状态下CO2的密度,NA为阿伏加德罗常数,m、△分别表示每个二氧化碳分子的质量和体积,下面是四个关系式
①![]() ②
②![]() ③
③![]() ④
④![]() 其中
其中
A.①和②都是正确的 B.①和③都是正确的
C.②和④都是正确的 D.①和④都是正确的
高一年级化学第一学期期中考试试卷
化 学
第Ⅰ卷 选择题答案(共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| |
| 答案 |
| |||||||
| 题号 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | ||||||||
第II卷 非选择题(共50分)
三、填空题(共40分)
15、本题共2小题,(共8分)
(1)下列关于容量瓶及其使用方法的叙述,正确的是 (填序号,多选倒扣分)
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④可用容量瓶贮存配制好的溶液
⑤可以用500mL容量瓶配制480mL溶液
6容量瓶上标有温度和容积
(2)下图表示分解、化合、置换、复分解四种反应类型和氧化还原反应的关系,请它们的对应关系填入下图中:
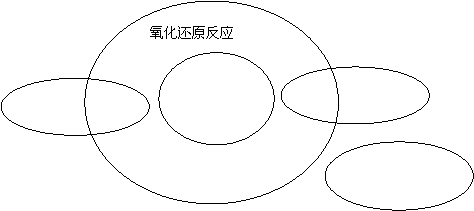

16、本题共2小题(共10分)
(1)等质量的CO和CO2,物质的量之比为 ;
氧原子个数之比为
同温同压下,CO和CO2的密度之比为 。
(2)200mL 1mol/L Al2(SO4)3溶液和100mL 2mol/LAl2(SO4)3溶液所含SO42—离子浓度之比为 ,SO42—离子数目之比为 。
17、本题共3小题(共10分)
(1)写出下列物质在水溶液中的电离方程式
氯化铜
硫酸铝
(2)写出下列反应的离子方程式
锌和稀硫酸反应
碳酸钙与稀盐酸混合
(3)标出下列反应的电子转移的方向和数目:
MnO2 + 4HCl(浓) === MnCl2 + Cl2 ↑ + 2H2O
18、(12分)某样品中含有碳酸钠及少量的硫酸钠和氯化钠。某学生为了检验其成分,按照下图所示步骤进行实验,请将所加试剂及有关结论填写在有序号的相应的空格中。
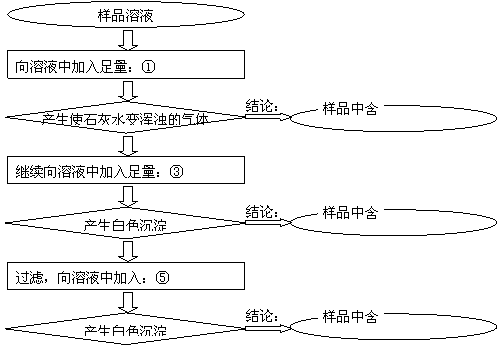 |
②
④
⑥
1 2 3
4 5 6
四 . 计算题 (本大题共3个小题,共10分)
19、(1)在标准状况下,将4.2gNaHCO3和过量的200ml HCl制CO2,理论上制备CO2多少L?(已知:NaHCO3+ HCl=NaCl+ H 2 O+ CO2 ↑)
(2)实际上由于一部分CO2溶解在反应后的混和溶液中,收集的CO2气体减少,已知每升溶液能溶解CO2 1.2L,则实际收集CO2多少升?(假设溶液体积变化忽略不计)
(3)如果某学生将实际质量为13.2g的NaHCO3错误地放在托盘天平的右盘上进行称量(5克以下用游码),根据他的称量结果进行计算,这些NaHCO3加热分解放出CO2的物质的量为多少?
高一年级化学第一学期期中考试试卷
化 学 答案
一、二选择题:(共50分)
1B 2 B 3A 4 C 5 C 6A (每题3分)
7D 8BD 9D 10C 11D 12CD 13 AC 14B (每题4分)
三、填充题:
15、(1)1255(4分)
(2)(4分)


16、(每空2分 共10分)
(1)11 :7 11 :14 7 :11
(2)3 :2 3 :1
17、(每空2分 共10分)
(1)CuCl2==== Cu2+ + 2 Cl-
Al2(SO4)3==2Al3++3SO42-
(2)Zn+ 2 H+==Zn2+ + H2↑
CaCO3+2H+ ===Ca2+ + CO2↑ +H2O
∣
(3) MnO2 + 4HCl(浓) === MnCl2 + Cl2 ↑ + 2H2O
18、(每空2分 共12分)
1 盐酸 2 碳酸 3 硝酸钡
4 硫酸钠 5 硝酸银 6 氯化钠
19、(1)1.12升(3分)
(2)0.88升(3分)
(3)0.1mol(4分)