高一年级化学第一学期期末检测试题
华中师大一附中 白和平
时限:90分钟 满分:108分
可能用到的原子量:H—1 O—16 Na—23 C—12 Ca—40 N—14 Cl—35.5 Br—80 F—19 K—39 Fe—56
一、选择题(只有一个选项,每小题3分,共54分)
1.化学式与俗名相符的是( )。
A.小苏打Na2CO3,苛性钠NaOH B.芒硝Na2SO4·10H2O,消石灰Ca(OH)2
C.苏打NaHCO3,石灰石CaCO3 D.纯碱NaOH,食盐NaCl
2.分别含有下列4种杂质的纯碱样品,当含杂质的质量分数相同时,取等质量的四种样品,与浓度相同的盐酸反应,所消耗盐酸的体积由多到少的顺序是( )。
杂质:①NaOH;②Ca(OH)2;③NaHCO3;④CaCO3
A.①②④③ B.③④①② C.②①④③ D.④③②①
3.用10 mL的0.1 mol·L-1BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )。
A.3:2:2 B.1:2:3 C.1:3:3 D.3:1:1
4.200 mL P%的盐酸(密度为![]() ),其物质的量浓度的计算式正确的是 (
)。
),其物质的量浓度的计算式正确的是 (
)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
5.下列反应,离子方程式正确的是( )。
A.Cl2与H2O Cl2+H2O=2H++Cl-+ClO-
B.铁与浓盐酸 2Fe+6H+=2Fe3++3H2↑
C.氢氧化铝与氢溴酸 Al(OH)3+3HBr=Al3++3H2O
D.过量CO2通入漂白粉溶液中 CO2+H2O+ClO-=HCO3-+HClO
6.配制一定体积、一定物质的量浓度的溶液时,下列哪种情况可能使溶液浓度偏小( )。
A.容量瓶中原有少量蒸馏水
B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视
D.滴管加水时,有少量水滴到容量瓶外
7.有关NA说法正确的是( )。
A.11.2 L的氯气中含NA个氯原子
B.常温常压下,18g的水含有的电子数为NA
C.1 L 1mol·L-1的稀盐酸中含有H+数约为NA
D.37 g 的Ca(OH)2含有的阴离子数为2NA
8.下列关于阿伏加德罗常数的说法不正确的是( )。
A.6.02×1023就是阿伏加德罗常数
B.0.012 kg12C含有的碳原子数就是阿伏加德罗常数
C.含有阿伏加德罗常数个粒子的物质的量是1 mol
D.1 mol NH3所含原子数约是2.408×1024
9.自来水可用氯气消毒。某学生用自来水配制下列物质的溶液,会引起药品变质的( )。
①AgNO3 ②FeBr2 ③烧碱 ④Na2CO3 ⑤Na2S ⑥CaCl2
A.除②⑤③外 B.④⑤⑥ C.①②③⑥ D.除⑥外
10.下列叙述中正确的是( )。
A.碘易升华所以要保存在铁盖旋紧的试剂瓶中
B.液溴应保存在磨口玻璃棕色试剂瓶中,并加少量水进行水封
C.能使湿润淀粉碘化钾试纸变蓝的气体一定是氯气
D.碘易溶于酒精,所以用酒精从碘水中萃取碘
11.由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为( )。
A.29:8:13 B.22:1:14
C.13:9:29 D.26:16:57
12.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的有关判断不正确的是( )。
A.该混盐与硫酸反应产生1 mol Cl2时转移2NA个电子
B.该混盐露置在空气中会变质
C.该混盐具有较强的氧化性
D.该混盐中氯元素的化合价为+1和—1
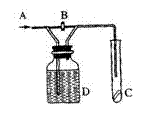 13.如右图所示,A处通入Cl2,关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C处红布条逐渐褪色,则D瓶中装的是(
)。
13.如右图所示,A处通入Cl2,关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C处红布条逐渐褪色,则D瓶中装的是(
)。
A.浓H2SO4 B.饱和NaCl溶液
C.稀盐酸 D.H2O
14.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的( )。
A.原子数 B.密度 C.质量 D.质子数
15.有五瓶溶液分别是:①10 mL 0.60 mol·L-1NaOH水溶液;②20 mL 0.50 mol·L-1H2SO4水溶液;③30 mL 0.40 mol·L-1HCl水溶液;④40 mL 0.30 mol·L-1CH3COOH水溶液,⑤50 mL 0.20 mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是( )。
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
16.已知浓H2SO4和Fe3+都可以将Cu氧化成Cu2+,浓H2SO4也可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3。由此可以确定上述有关物质氧化性由强到弱的顺序为 ( )
A.浓H2SO4>Br2>Fe3+>Cu2+ B.浓H2SO4>Cu2+>Fe3+>Br2
C.Br2>浓H2SO4>Fe3+>Cu2+ D.Fe3+>Cu2+>Br2>浓H2SO4
17.下列既能发生氧化还原反应,又能发生复分解反应的离子组是( )。
A.Na+、H+、ClO-、S2- B.NH4+、Na+、MnO4-、I-
C.K+、Ba2+、Br-、NO3- D.Mg2+、Ag+、OH-、PO43-
18.某固体物质W在一定条件下加热分解:2W ![]() X+2Y+4Z,已知生成物均为气体。现测得生成的混合气体在标准状况下250毫升的质量为0.255克,W的式量约为( )
X+2Y+4Z,已知生成物均为气体。现测得生成的混合气体在标准状况下250毫升的质量为0.255克,W的式量约为( )
A.79.97 B.22.85 C.159.91 D.45.69
二、填空题
19.(5分)
(1).在HF、HCl、HBr、HI中,热稳定性最强的是__________,它们相应的水溶液中,以_______(名称)酸性最弱,____________(名称)酸性最强,_______________还原性最强。___________的水溶液可用于雕刻玻璃。
(2)(5分).在AgF、AgCl、AgBr、AgI中,溶解度最小的是_____________,用于人工降雨的是___________,对光的稳定性最弱的是_______________,照相用的胶卷和相纸上都有一层药膜,其感光物质的主要成分是分散于明胶层中的______________。
卤素单质中,___________酒精溶液,医疗上外用作消毒杀菌剂。
(3)(13分).实验室用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。
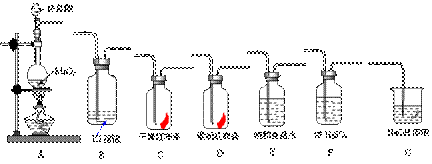
①上述装置中各仪器从左至右的连接顺序为_____接_____接_____接_____接_____接_____接______。
②E装置的作用是_____________________,G装置的作用是___________________,D中的现象为_______________________,B中的现象为___________________________
③写出下列反应的离子方程式:A中_______________________________________, B中___________________________________,G中_________________________________。
三、推断题
20(8分).A、B、C、D、E五种化合物均含有相同的一种元素X,C和D的水溶液分别与AgNO3溶液混合时,其中的X跟Ag+结合成不溶于稀HNO3的白色沉淀,A、B、E中的X元素则不能。A在催化剂和加热条件下可分解生成C和气体F,F能使余烬的木条复燃。D与KOH溶液反应生成C和水。B与A的组成元素完全相同,在B的水溶液中通入CO2生成E和另外一种物质,E见光分解生成D和F。试回答:
(1)写出A、B、C、D、E、F六种物质的化学式:
A ,B ,C ,D ,E ,F
(2)写出下列指定反应的化学方程式:
A分解生成C和F:
E见光分解:
四、计算题
21(9分).将5.00 g 氯化钠、溴化钠和氯化钙的混和物溶于水,通入足量Cl2充分反应,然后把溶液蒸干并灼烧(高温加热),灼烧后残留物的质量为4.914 g 。若将此残留物再溶于水加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为0.270 g 。求混和物中各化合物的质量分数(写解题过程)。
22(6分).在反应3BrF3+5H2O====HBrO3+Br2+O2↑+9HF中,若有90 g水被氧化时,则反应中被还原的BrF3物质的量是 摩尔,若有90 g 水参加反应,则被水所还原的BrF3物质的量是 摩尔。
23(8分).将5.21 g 纯铁溶解于足量的稀硫酸中,在加热条件下用2.53 g 硝酸钾去氧化所生成的亚铁离子到铁离子,充分反应后余下的亚铁离子还需0.009 mol 氯气才能完全氧化,则硝酸钾还原产物中氮元素的化合价是 价,反应过程中涉及到反应的离子方程式为 , ,
(提示:氮的+1、+2、+3、+4、+5价化合物分别为N2O、NO、N2O3、NO2、N2O5)。
试题参考答案
一、选择题(总分54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | C | B | D | B | C | A | D | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
| 答案 | D | A | A | A | D | A | A | A |
|
|
二、填空题
19.(1)(5分)HF或氟化氢,氢氟酸,氢碘酸,HI或氢碘酸,HF
(2)(5分)AgI,AgI,AgI,AgBr,I2或碘
(3)①(3分)AEFCDBG
②(4分)吸收Cl2中的HCl气体;吸收尾气Cl2防止污染环境;红色褪去,溶液由无色变为棕黄色或黄色或棕色
③(6分)MnO2+2Cl-+4H+ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
2I-+Cl2=I2+2Cl- Cl2+2OH-=Cl-+ClO-+H2O
三、推断题
20.(1)(6分)A—KClO3 B—KClO C—KCl D—HCl E—HClO F—O2
(2)(2分)2KClO3 ![]() 2KCl+3O2↑
2HClO
2KCl+3O2↑
2HClO ![]() 2HCl+O2↑
2HCl+O2↑
四、计算题
21.(9分)解:设混和物中NaCl为x,NaBr为y,CaCl2为z。
则 x+y+z=5
2NaBr+Cl2===2NaCl+Br2固体质量减少
2×103 2×58.5 (103-58.5)×2=89
y (5-4.914)=0.086
y=0.200
CaCl2+Na2CO3===CaCO3↓+2NaCl
111 100
z 0.270 g
z=0.300 g
x=5-0.200-0.300=4.500 g