高一化学第一学期期末模拟考试试题(一)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间90分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32
Cl-35.5 Mn-55 Fe-56
第Ⅰ卷(选择题 共50分)
一、选择题(每小题2分,共10题共20分,每题只有一个选项符合题意)
1.“关注民生”和“科学发展”是“十七大”报告的主题之一,环境问题与“民生”和“科学发展”密切相关。近来我国许多城市将市区汽车排气管装上催化转换器,目的是使:碳氢化合物迅速转化为二氧化碳和水;氮的氧化物转化为氮气,使汽车尾气得到净化。关于这两个目的所涉及的物质变化,说法正确的是( )
A.均为物理变化 B.均为化学变化
C.前者为物理变化,后者为化学变化 D.前者为化学变化,后者为物理变化
2.下列物质中,含有自由氯离子的是
①食盐溶液 ②氯化氢溶液 ③氯酸钾 ④液态氯化氢 ⑤氯水
A.①②③ B.②③④ C.③④⑤ D.①②⑤
3.提纯含有食盐杂质的碘,常用的方法是
A.分液 B.蒸馏 C.过滤 D.升华
4.将新制的氯水滴入下列溶液中,不发生反应的是
A.碘化钠 B.硫酸铁
C.硝酸银 D.氢氧化钾
5.工业上铝常用于冶炼难熔金属,这一用途主要是由于铝
A.具有强还原性,反应中放出大量的热 B.高温时在空气中能燃烧
C.具有良好的导热性 D.反应后生成熔点更高的氧化铝
6.已知溶液中有Mg2+、Al3+、Cl-、SO42-、-四种离子,已知其中Mg2+、Al3+、Cl-离子个数比为4:5:3,则Cl‑与SO42-的离子个数比为
A.2:1 B.3:10 C.5:3 D.10:3
7.下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到金属的单质
C.能与酸反应的氧化物,不一定是碱性氧化物
D.电离时能生成H+的化合物是酸
8.在标准状况下与12g H2体积相等的N2所具有的 ( )
A.质量为12 g B.物质的量是为6mol
C.体积为130L D.分子数为12NA
9.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是 ( )
A.氯化钠 B.固体硝酸铵
C.固体氢氧化钠 D.生石灰
10.在一定条件下,RO3n-和氟气可发生反应:RO3n- + F2+2OH-=RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是
A.+4 B.+7 C.+6 D.+5
二、选择题( 每题3分、共10题共30分,每题可能有二个选项符合题意,若是多选题选取对一个且只选一个得1分,选错不得分 )
11.下列各组离子,在碱性溶液中可以大量共存的是
A.K+、Na+、AlO2-、Cl- B.Na+、Al3+、SO42-、NO3-
C.NH4+、K+、CO32-、SO42- D.Ba2+、Na+、NO3-、Cl-
12.相同物质的量浓度的NaCl,MgCl2,FeCl3溶液,分别与等量的AgNO3溶液完全反应,所用去三种溶液的体积比为
A.6:3:2
B.1:2:3 C.3:2:1 D.![]() :
:![]() :1
:1
13.不能用碘化钾淀粉试纸鉴别的一组溶液是
A.氯水、溴化钠 B.碘化钾、碘水
C.溴水、氯化钾 D.氯水、溴水
14.用自来水养金鱼之前,应先将自来水放在阳光下曝晒一段时间,其目的是
A.紫外线消毒,杀菌 B.增加水中的氧气
C.除去水中的次氯酸 D.提高水的温度
15.标准状况下将充满HCl气体的烧瓶倒置于水中,水充满整个烧瓶后,溶液的物质的量浓度是(假设HCl没有扩散到瓶外)
A.1mol/L B.22.4mol/L C.![]() mol/L D.无法确定
mol/L D.无法确定
16.不能用金属单质和稀盐酸反应制得的物质是
A.FeCl3 B.AlCl3 C.FeCl2 D.CuCl2
17.100ml 0.3mol/L Na2SO4溶液和50ml 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-离子的浓度为(假设体积变化忽略不计)
A.0.20mol/L B.0.25mol/L C.0.40mol/L D.0.50mol/L
18.下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液 CH3COOH+NH3 == CH3COONH4
B.澄清的石灰水跟盐酸反应 H++OH— == H2O
C.碳酸钡溶于醋酸 BaCO3+2H+ == Ba2++H2O+CO2↑
D.金属钠跟水反应 Na+H2O == Na++OH—+H2↑
19.除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及其顺序正确的是
A.Na2CO3、 AgNO3、HNO3 B.AgNO3、Na2CO3、HCl
C.AgNO3、Na2CO3、HNO3 D.AgNO3、K2CO3、HNO3
20.下列实验操作中的仪器需要插入液面下的是
A.制备Fe(OH)2,用胶头滴管将氢氧化钠溶液滴入FeSO4溶液中
B.制备二氧化碳的简易装置中长颈漏斗的下端管口
C.制蒸馏水时,控制温度所用的温度计
D.向试管中的BaCl2溶液里滴加稀硫酸所用的滴管
第Ⅱ卷(非选择题 共50分)
三、填空题(每空1分,共18分)
21.针对以下①-④四个涉及H2O2的反应(未配平),填写下列空白。
①Na2O2+HCl→H2O2+NaCl ②Ag2O+H2O2→Ag+O2↑+H2O
③H2O2→H2O+O2↑ ④H2O2+Cr2(SO4)3+KOH→KCrO4+K2SO4+H2O
(1)H2O2仅表现氧化性的是(填代号,下同)_______________________
(2)H2O2既表现氧化性又表现还原性的反应是_____________________________
(3)H2O2体现弱酸性的反应是_____________,其理由是___________________________
22.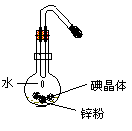 按右图装置进行实验。烧瓶里放入少量碘晶体和锌粉和混 合物,当水滴入混合物后,观察到烧瓶里有紫红色的气体产生。 根据实验现象进行推断:
按右图装置进行实验。烧瓶里放入少量碘晶体和锌粉和混 合物,当水滴入混合物后,观察到烧瓶里有紫红色的气体产生。 根据实验现象进行推断:
(1)紫红色的气体是 。
(2 )反应中的能量变化: (填吸热或放热)。
判断理由是: 。
(3)反应中水的作用 。
(4)写出反应的化学方程式: 。
23.Al(OH)3和NaHCO3都是治疗胃酸过多的药物,用离子方程式表示其原理,
。 。
根据上述反应,如果是胃酸过多且胃溃烂的患者,应该选用上述哪一种药物治疗
为好 ,理由是 。
24.A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,B的溶液中阴离子只有一种,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。
试推断
A:________ B:________ C:_________ D:_________ E:
四、实验题(16分)
25.在右图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶。
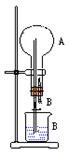 (1)若A为HCl气体,B为石蕊试液,则形成红色喷泉。试分析红色喷泉形成的原因
(1)若A为HCl气体,B为石蕊试液,则形成红色喷泉。试分析红色喷泉形成的原因
(2)请你根据喷泉形成的原理,选择适当的A和B来完成喷泉试验(至少通过三种途径且其中一种喷泉为有色)。将你的选择填入下表:
| A | B | 喷泉颜色 | |
| 途经1 | |||
| 途经2 | |||
| 途经3 | |||
(3)某学生利用氯化氢和水做喷泉试验(氯化氢为该学生制备和收集),结果有喷泉,但烧瓶中上升的液体只占三分之二左右。请你分析液体未能全部充满烧瓶的可能原因。
(4)对一定物质的量的气体,其气体压强P、体积V、温度T、物质的量n之间的关系可用克拉伯龙方程表示:PV=nRT(R为常数),你能否根据此关系再找出能够完成喷泉实验的其他条件?并简述操作要点。
四、计算题(每题8分,共16分)
26.往100mL1mol/L的AlCl3溶液中加入1mol/L的NaOH溶液。求:
(1) 当生成Al(OH)3沉淀最多时,加入的NaOH溶液的体积是多少?
(2) 当加入350mLNaOH溶液时,产生的沉淀的质量
27.把BaCl2•XH2O的晶体2.44g溶于水,配成100mL溶液,取此溶液25mL,与50mL0.1mol/L的AgNO3溶液相相作用,刚好把Cl- 离子沉淀完全。求:
⑴ 2.44gBaCl2•XH2O的物质的量。
⑵BaCl2•XH2O的相对分子质量。
⑶BaCl2•XH2O的X值。
高一化学模拟考试(一)参考答案与评分标准
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | D | D | B | A | B | C | B | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AD | A | D | C | C | AD | C | B | C | AB |
三、填空题(每空1分,共18分)
21.(1)④ (2)③ (3)① 这一反应可看作强酸制弱酸的反应
22.(1)碘蒸汽 (2)放热 碘受热升华为碘蒸汽
(3)催化剂 (4)Zn+I2![]() ZnI2
ZnI2
23.Al(OH)3 + 3H+ ==== Al3+ + 3H2O HCO32— + H+ === CO2 ↑ + H2O
Al(OH)3 碳酸氢钠和酸反应会产生CO2,引起胃穿孔。
24.A:Na2CO3、B:KOH、C:NaHCO3 D:NaCl、E:Fe(OH)3
四、实验题(16分)
25. (1) 2’当滴管中的水挤入烧瓶后,由于氯化氢极易溶于水,使烧瓶内的气体压强比大气压小得多,故水通过导管被压入烧瓶,形成喷泉。由于HCl的水溶液显酸性,使石蕊试液变红,形成红色喷泉。
(2) 3’ 途径1 HCl AgNO3溶液 白色
途径2 Cl2 NaOH溶液 无色
途径3 CO2 NaOH溶液 无色
途径4 Cl2 淀粉碘化钾溶液 蓝色
途径5 Cl2 溴化钠溶液 橙色
(3)2’ 收集HCl时空气未排尽;烧瓶漏气;烧瓶潮湿;挤入烧瓶的水太少,导管有太长等。
(4)2’降低温度。
四、计算题(每题8分,共16分)
26、300mL 3.9g
27、(1)0.01mol
(2)244
(3)X=2