高一化学第一学期期末统一考试
高一化学试卷
本试卷分第Ⅰ卷(选择题)第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至7页。满分100分。考试时间90分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Mg:24 Al:27 S:32 Fe:56
注意事项:
1、答题前,考生必须将自己的姓名、统考考号、座位号、考试科目用铅笔涂写在答题卡上。
2、第Ⅰ卷共30小题:每小题选出答案后,用铅笔把答题卡上对应的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案。第Ⅱ卷则用黑色钢笔(或圆珠笔)按各题要求答在答题卡相应的位置上。
3、考试结束后,将答题卡交回。
第Ⅰ卷(选择题,共60分)
一、选择题(本题共30小题,每小题2分,共60分,每小题只有一个正确选项。)
1.下列说法正确的是( )
A.人们所使用的物质,都是纯度越高越好
B.混合物的性质比其中各种纯净的组分物质都好
C.天然物质都比人造物质好
D.化学反应进行得越快、越彻底不一定就越好
2.下列观点中不正确的是( )
A.通过化学变化一定能改变物质的性质
B.改变物质的性质一定要通过化学变化
C.氧化还原反应中一定会发生电子转移
D.有电子转移的化学反应一定是氧化还原反应
3.下列对“摩尔(mol)”的叙述不正确的是( )
A.摩尔是一个单位,用于计量物质所含微观粒子的多少
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1mol任何气体所含的气体分子数目都相等
D.用“摩尔”(而不用“个”)计量微观粒子与用“纳米”(而不用“米”)计量原子直径,计量思路都是扩大单位
4. 相同状况下,下列气体所占体积最大的是( )
A. 80g SO3 B. 16g O2 C. 3g H2 D. 32g H2S
5.若NA表示阿佛加德罗常数,下列说法正确的是( )
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷(CH4)的质量比为7 :4
6.配制500mL 2mol/L NaOH溶液所需NaOH的质量为( )
A. 40g B. 20g C. 50g D. 80g
7.下列化学实验符合“绿色化学”的有( )
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
②在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
③将实验室的废酸液和废碱液中和后再排放
A. ①②③ B. ①③ C. ②③ D. ①②
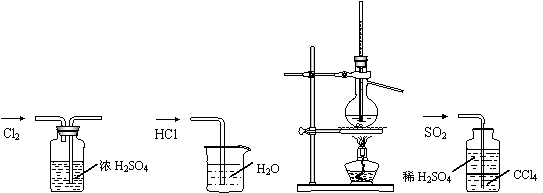
8.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
A.干燥Cl2 B.吸收HCl C.制取蒸馏水 D.吸收SO2
9. 下列除去杂质的方法不正确的是( )
A. Cl2中混少量HCl,通过碱石灰收集气体
B. Na2CO3固体中混有少量NaHCO3固体,充分加热至质量不变
C. SO2中混有少量SO3,通过足量浓硫酸,收集气体
D. Mg粉中混少量Al粉,加足量烧碱溶液,充分反应后过滤
10. 下列分散系属于胶体的是 ( )
A.泥水 B.食盐水 C.淀粉溶液 D.碘酒
11. “纳米材料”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是 ( )
A.能全部透过半透膜 B.有丁达尔效应
C.所得液体一定能导电 D.所得物质一定为悬浊液或乳浊液
12.下列反应的离子方程式正确的是( )
A.锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B. 碳酸氢钠溶液加到醋酸中:NaHCO3+CH3COOH=Na++CH3COO-+CO2↑+H2O
C.少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
13.下列有关钠的叙述中,错误的是( )
A. 钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B. 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C. 钠是一种灰黑色的固体
D. 钠的质地软,可用小刀切割
14. 对于反应H-+NH3=H2+NH2-的正确说法是( )
A. 属于置换反应 B. H-是氧化剂
C.NH3是还原剂 D. H2既是氧化产物又是还原产物
15.为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它( )
①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子
A. ②③ B. ①③ C. ①④ D. ③④
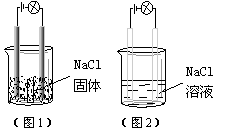 16. 某同学在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )。
16. 某同学在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() A. NaCl是非电解质
A. NaCl是非电解质
B. NaCl溶液是电解质
C. NaCl在水中电离出可以自由移动的离子
D. NaCl溶液中水电离出大量的离子
17. 不能用金属跟氯气直接反应制得的氯化物的是 ( )
A.NaCl B.MgCl2 C.CuCl2 D.FeCl2
18.氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A. 若管道漏气遇氨就会产生白烟 B. 该反应利用了Cl2的强氧化性
C. 该反应属于复分解反应 D. 生成1molN2有6mol电子转移
19.下列说法正确的是( )
A. 硅材料广泛用于光纤通讯
B. 工艺师利用盐酸刻蚀石英制作艺术品
C. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
D. 粗硅制备单晶硅不涉及氧化还原反应
20. 高层大气中的臭氧层保护了人类生存的环境,其作用是( )
A. 消毒 B. 漂白 C. 保温 D. 吸收紫外线
21. 下列变化中,不属于化学变化的是( )
A.SO2使品红溶液褪色 B.氯水使有色布条褪色
C.活性炭使红墨水褪色 D.O3使某些染料褪色
22.用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内的氨水的物质的量浓度是(按标准状况下计算)
A.0.045mol·L-1 B.1mol·L-1 C.0.029mol·L-1 D.不能确定
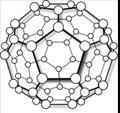 23.近年科学家制得一种新的分子,它的结构如图,化学式为C60。下列说法中正确的是( )
23.近年科学家制得一种新的分子,它的结构如图,化学式为C60。下列说法中正确的是( )
A. C60是碳的一种同素异形体
B. C60是一种新型的化合物,有着重要的应用
C. C60分子的摩尔质量为720
D. C60的相对分子质量为720 g / mol
24.二氧化硅是酸性氧化物是因为 ( )
A. 硅是非金属 B . 它的对应水化物是弱酸,能溶于水
C . 它是非金属氧化物 D. 二氧化硅能跟氢氧化钠反应生成盐和水
25. 能证明硅酸的酸性弱于碳酸的酸性的实验事实是( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
26. 将等体积的NO2和N2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积约为原总体积的( )
A. 1/6 B. 1/3 C. 2/3 D. 1/2
27. 检验某固体样品中是否含有NH4+的方法是,先取少量固体于试管中,然后 ( )
A.加热,用湿润红色石蕊试纸在试管口检验
B.加水溶解,用红色石蕊试纸检测溶液酸碱性
C.加入弱碱溶液,加热,滴入酚酞试剂
D.加入烧碱溶液,加热,用湿润石蕊试纸在试管中检验
28.在氧化铁和盐酸混和溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )。
A.H+ B.Fe2+ C.Fe3+ D.Cl-
29. 将钠、镁、铝各0.3mol 分别放入100mL 1 mol/L 的盐酸中,同温同压下产生的气体体积比是( )
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
30. 将过量铁粉放入100mL 2mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应Fe的质量为( )
A. 2.8g B. 5.6g C. 4.2g D. 11.2g
第II卷(共40分)
二、填空题(本题包括3小题,共22分)
31.(7分)
(1)电解饱和食盐水可以制得烧碱、氯气和氢气,该反应的化学方程式为:
。
(2)氯气用于生产半导体材料硅的流程如下:
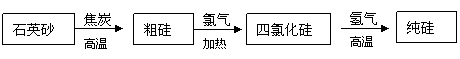 |
①石英砂的主要成分是 ,在制备粗硅时,焦炭的作用是 。
②粗硅与氯气反应后得到的液态四氯化硅中常混有一些杂质,必须进行分离提纯。其提纯方法为 。
③由四氯化硅得到高纯硅的化学方程式是:
。
32.(9分)
铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途。
(1)铝制容器不能盛装NaOH溶液,主要原因是什么?(用化学方程式表示)
;
(2)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示):
;
碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式:
;
(3)为完全沉淀硫酸铝溶液中的铝元素。常加入过量的 ,
反应的离子方程式: 。
33.(6分) A、B、C、D、E 五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是 。
(2) A是 ,B是 ,C是 ,
D是 ,E是 。
三、实验题(本题包括2小题,共11分)
34.(5分)当我们轻轻拧开水龙头的时候,洁净的自来水“哗哗”流出时;你可曾想过自来水是怎样来的?下图是中山市自来水公司生产工艺流程图:
 |
请回答下列问题:
(1)抽水泵站将源水抽起,加氯系统加氯,目的是 ;
 (2)常用
作净水剂;
(2)常用
作净水剂;
(3)右图为过滤池,在实验室要完成过滤,需要的玻璃仪器有 、 、 。
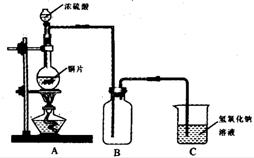 35. (6分)某研究性小组为探究铜跟浓
35. (6分)某研究性小组为探究铜跟浓
硫酸的反应情况,设计了如图所示装置进行有关实验:实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中有铜剩余。
(1)写出铜跟浓硫酸反应的化学方程式:
。
(2)该小组认为还应有一定量的硫酸剩余。请说明铜片未完全溶解并仍有一定量余酸的原因: 。
(3)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的 (填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
四、计算题(本题包括1小题,共7分)
36. (7分)将镁铝的固体混合物0.1mol溶于100mL 2mol·L-1稀硫酸中充分反应后,固体全部溶解,然后再向反应后的混合溶液中滴加1mol·L-1NaOH溶液。
(1)若在滴加NaOH溶液过程中,使Mg2+、Al3+全部生成沉淀,则滴入的NaOH溶液体积是 mL。
(3)设0.1mol镁铝固体混合物中Mg的物质的量分数为a,若在滴加NaOH溶液450mL后,所得沉淀只有Mg(OH)2,则a的取值范围是 。
高一化学期末考试试题答案及评分标准
一、选择题(本题包括30小题,共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | B | D | C | C | A | A | C | A | C | B | D | C | D | B |
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | C | D | C | A | D | C | A | A | D | B | C | D | B | C | C |
二、填空题(本题包括3小题,共22分)
|
(1)2NaCl + 2H2O ==== 2NaOH + H2↑+ Cl2↑(2分)
(2)①SiO2(1分) 还原剂 (1分)
|
③SiCl4 + 2H2 ==== Si + 4HCl(2分)
32.(9分)
(1)2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑(2分)
(2)Al(OH)3+3H+ = Al3++3H2O(2分)
H+ + HCO3- = CO2↑ + H2O(2分)
(3)氨水(1分)
Al3+ + 3NH3·H2O = Al(OH)3↓+3NH4+(2分)
33.(6分)
(1)AgCl (2)Na2CO3 HCl AgNO3 BaCl2 NaHSO4 (各1分)
三、实验题(本题包括2小题,共11分)
34.(5分)
(1)杀死水中的病菌(1分)
(2)明矾[或KAl(SO4)2·12H2O] (1分)
(3)漏斗 、 烧杯 、 玻璃棒 (各1分)
|
(1)Cu + 2H2SO4 ==== CuSO4 + SO2↑ + 2H2O(2分)
(2)反应过程中H2SO4被不断消耗,且生成的水逐渐增多,使浓硫酸浓度变稀,至一定浓度时就不再与铜片反应。(2分)
(3)AD(2分)
四、计算题(本题包括1小题,共7分)
36.(7分)(1)400 (3分) (2)0.5≤a<1(4分)