高一化学第一学期期末考试
化 学
本试卷包括第1卷(选择题)和第Ⅱ卷(非选择题)两部分。第1卷1至4页,第Ⅱ卷5至8页。全卷满分100分,考试时间120分钟。
第1卷(选择题共50分)
注意事项:
1.答第1卷前,请考生务必将自己的姓名、准考证号、考试科目用2B铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。不能答在试题卷上。
3.考试结束后,监考人将第Ⅱ卷和答题卡一并收回。
可能用到的相对原子质量:H一1 He一4 C—12 N一14 0一16 Na一23 S一32 Cl一35.5 K一39 I一127
一、选择题(本大题包括25小题,每小题2分,共50分)每小题只有一个选项符合题意。
1.当今世界,能源之争日趋激烈。下列能源燃料中,不属于化石燃料的是
A.煤炭 B.石油 C.天然气 D.水煤气
2.北京时间2007年10月24日,“嫦娥一号”顺利升空,让一个民族几千年追月的梦想逐步变为现实,中国开始了自己的探月计划。此计划完成后将为下一步载人登月探测、建立月球前哨站的选址提供数据资料。若要载人登月,应选择下列哪种物质作为供氧剂
A.KClO, B.KMnO4 C.Na2O2 D.H2O
3.油炸虾条、薯片等挤压易碎的食品不宜采用真空包装,一般在包装袋中充人某种气体防止食品被直接挤压,你认为下列气体中不宜充人包装袋的是
A.氮气 B.空气 C.氯气 D.氩气
4.碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一问题,我国已经开始实施“智力工程”,最经济可行的措施是
A.大量食用海带 B.食用加碘盐 C.面包加碘盐 D.注射含碘药剂
5.下列反应中,既属于氧化还原反应,又是离子反应的是
A.铝片与稀盐酸的反应 B.甲烷与氧气的反应
C.灼热的炭与二氧化碳反应生成一氧化碳 D.氢氧化钠溶液与稀盐酸的反应
6.钠与水反应的现象与钠的下列性质无关的是
A.钠的熔点较低 B.钠的密度小于水 C.钠的硬度较小 D.钠的还原性强
7.下列叙述不正确的是
A.燃烧不一定要有氧气参加,任何发光、发热的剧烈的化学反应.都可以叫做燃烧
B.将F、Cl、Br、I归为一族的根本原因是它们最外层电子数均为7个,有相似的化学性质
C.在医疗上,碳酸氢钠是治疗胃酸过多症的一种药剂
D.钠着火引起火灾时,可用泡沫灭火器灭火
8.只具有还原性的一组粒子是
A.Na、Cl-、S2- B.Cl-、CO、Na+ C.Fe3+、SO42-、NO3- D.Fe2+、O2、H2S
9.下列叙述正确的是
A.1mol任何气体的体积一定是22.4L
B.同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C.在标准状况下,体积为22.4L的物质都是lmol
D.在非标准状况下,1 mol任何气体的体积都不可能是22.4L
10.下列物质的保存方法不正确的是
A.新制氯水应放在棕色瓶中密封保存 B.盛液溴的试剂瓶中常加少量水
C.少量的金属钠应保存在煤油中 D.固态碘放在棕色细口瓶中
11.设NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4L氖气含有2NA个原子
B.常温常压下,0.1NA个H2S分子的质量为3.4g
C.7.1g Cl:变为氯离子时,得到的电子数为0.1N。
D.若1g N2含有m个分子,则NA=rn/28
12.已知:Fe+2HCl==FeCl2+H2 ↑; 4HCI(浓)+MnO2==MnCl2+ Cl2↑+2H20,试判断以下关于盐酸性质的叙述中正确的是
A.有酸性和氧化性;无还原性 B.有酸性、氧化性和还原性
C.有酸性、还原性;无氧化性 D.有氧化性和还原性;无酸性
13.用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
A干燥的 B.用欲配制的溶液润洗过的 C.瓶塞不漏水的 D.以上三项均须要求的
14.根据下列化学方程式:2FeCl3+2KI=2FeCl2+2KCI+12,2FeCl2+C12=2FeCl,,
2KMnO4+16HCl=2MnCl2↑+5C12↑+8H2O,判断各物质氧化性由强到弱的顺序正确的是
A.KMnO4>C12>FeCl3>I2 B.I2>C12>FeCl3>KMnO4
C.C12>I2>FeCl3>KMn04 D.FeCl3>KMnO4>C12> I2
15.下列各图中,小白球(O)代表氢原子,大灰球(●)代表氦原子。最适合表示标准状
况时,等质量的氢气与氦气的混合气体的是

16.下列离子方程式书写不正确的是
A.氯化钠溶液中加入硝酸银溶液:Ag++C1- =AgCl ↓
B.把金属钠放人水中:2Na+2H20=2Na++20H-+H2↑
 C.氯气与水反应:C12+H20=2H++CI-+ClO-
C.氯气与水反应:C12+H20=2H++CI-+ClO-
D.澄清的石灰水跟盐酸反应:H++0H-==H2O
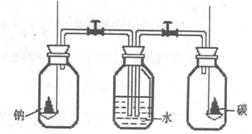
17.将钠和碳分别置于右图所示的两个盛满氧气的集气瓶中燃烧完毕后,同时打开装置中的两个活塞,这时观察到
A.水进入左瓶
B.水进入右瓶
C.水同时进入两瓶
D.水不进人任何一瓶钠
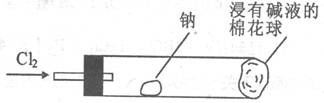 18.大多数金属在加热或灼烧的条件下,都能与氯气发生反应生成氯化物。下图所示装置可用作金属钠与氯气反应实验。玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,当钠熔融成小球时(玻璃管内预先用氮气排出了空气),撤火,通人氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
18.大多数金属在加热或灼烧的条件下,都能与氯气发生反应生成氯化物。下图所示装置可用作金属钠与氯气反应实验。玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,当钠熔融成小球时(玻璃管内预先用氮气排出了空气),撤火,通人氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
A.反应生成的白烟是氯化钠晶体
B.钠着火燃烧产生苍白色火焰
C.浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.若在棉球外缘滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
19.下列各组离子中,能在溶液中大量共存的是
A.H+、Ca2+、Cl-、C032-- B.I-、CIO-、K+、H+
C.Na+、HC03--、S042-、OH- D.Na+、Cu2+、Cl-、SO42-
20.将标准状况下的a L氯化氢气体溶于1000g水中,得到的盐酸的密度为bg/mL,则该盐酸的物质的量的浓度是(单位:mol·L。)
A ![]() B.
B.![]() C.
C.![]() D.
D.![]()
21.下列关于新制氯水及久置氯水的说法中不正确的是,
A.新制氯水放置数天后,酸性增强
B.新制氯水中滴加紫色石蕊试液先变红,后褪色
C.新制的氯水所含成分多,而久置的氯水所含成分少
D.光照氯水有气泡逸出,该气体是C12
22.做焰色反应实验时所用的铂丝,每次用毕后都要
A.用水多洗几次
B.先用稀盐酸洗,再用水洗
C.用稀盐酸洗,再在火焰上灼烧到没有什么颜色为止
D.放在火焰上灼烧,直到铂丝发红为止
23.①将l L 1 .00 mol·L。的纯碱溶液逐滴加入到l L 1.25 mol·L。的盐酸中;②将1L 1.25 mol‘L“的盐酸逐滴加人到1 L 1.00 mol·L“的纯碱溶液中,前后两次操作在同温同压下产生气体的体积比是(假设产生的气体全部逸出)
A.2:5 B.1:l C.2:1 D.5:2
24.下列各溶液中,Na’的物质的量浓度最大的是
A.4L 0.5mol/L NaCI溶液 B.1L 0.3mol/I。Na2S04溶液
C.5L 0.4mol/L NaOH溶液 D.2L 0.15mol/L Na3P04溶液
25.在标准状况下有:①6.72L CH4 ②3.01×1023个氯化氢分子 ③13.6g硫化氢 ④0.2mol氨气。下列对这四种气体相关量的比较不正确的是
A.体积:②>③>①>④ B.密度:②>③>④>①
C.质量:②>③>①>④ D.氢原子数:①>④>③>②
第Ⅱ卷(非选择题共50分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔将答案直接答在试卷上。
2.答题前,务必将密封线内的项目填写清楚。
3.考试结束,将第Ⅱ卷和答题卡一并交回。
二、【本题包括3小题,共14分)
26.(6分)高锰酸钾和浓盐酸可以发生下列反应
2KMnO4+16HCl=2MnCl2↑+5C12↑+8H2O
(1)用双线桥在方程式上标出该反应中电子转移的方向和数目。
(2)若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量为 mol。
(3)该反应的离子方程式是
27.(4分)与54g水所含原子总数相同的固态碘是 mol;同温同压下,同质量的氯气和二氧化碳气体的体积比为
28.(4分)某二价金属的氯化物19g,其中含有0.4molCl-,此氯化物的摩尔质量为 ,该金属元素的相对原子质量是
三、(本大题包括3小题,共14分)
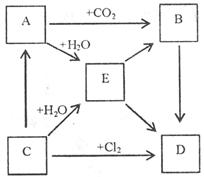 29.(6分)右图表示A.B.C.D.E五种物质的相互转化关系,其中A为淡黄色固体,C为单质,D为离子化合物。
29.(6分)右图表示A.B.C.D.E五种物质的相互转化关系,其中A为淡黄色固体,C为单质,D为离子化合物。
(1)(用化学式表示)A是 C是 D是
(2)写出下列转化的方程式
A—→B(化学方程式):
A—→E(离子方程式)
B—→D(化学方程式)
30.(4分)某学生往一支试管里按一定的次序分别加入下列几种物质:A.KI溶液;B.淀粉溶液;C.NaOH溶液;D.氯水。发现溶液颜色按下面次序变化:①无色一→②黄褐色一→③蓝色一→④无色。依据溶液颜色的变化回答下列问题:
(1)加入以上药品的顺序是 (填物质对应的字母)。
(2)写出①一→②变化的离子方程式
31.(4分)下表是某地市场上销售的一种“加碘盐”包装袋上的部分文字说明。请根据此表,结合学过的化学知识,回答下列问题(提示:1 mg=1x10-3g):
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘 | 35mg,/kg |
| 储藏方法 | 密封避光、防潮 |
| 使用方法 | 烹调时待食品熟后加入碘盐 |
(1)已知在溶液中IO3一可与I一反应:IO3一+5I一+6H+=3I2+3H2O。根据此反应,可用试纸和一些生活中常见物质进行实验,证明在食盐中存在IO3一可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④食糖;⑤淀粉;⑥白酒;⑦食醋。进行实验时必须使用的物质是(填写序号)
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时
(3)若成人每天需摄人0.15 mg一0.20 mg碘才能满足人体健康的需要,试计算每人平均每天食用5.0 g这种加碘盐 (填“能”或“不能”)获得所需要的碘。
四、(本大题包括3小题.共16分)
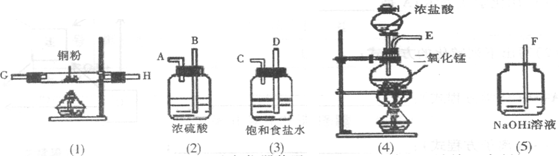 32.(6分)实验室中用下列仪器和药品来制取纯净的无水CuCI2,图中的A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出。
32.(6分)实验室中用下列仪器和药品来制取纯净的无水CuCI2,图中的A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出。
①如果所制气体从左到右流向,上述各仪器装置正确连接顺序是(填接口字母):
( )接( )接( )接( )接( )接( )接( )接( )
 ②装置(2)的作用是
装置(3)中的溶液可否用蒸馏水代替 (填“能”或“不能”);
②装置(2)的作用是
装置(3)中的溶液可否用蒸馏水代替 (填“能”或“不能”);
③实验开始前,应首先检验装置的 ;若将装置(2)中出来的气体通到右图的广口瓶中,其现象为
④装置(1)中发生反应的化学方程式为
33.(6分)实验室需要200mL 0.8mol/L。的NaOH溶液。
(1)需称取NaOH固体的质量为 g。
(2)在下列仪器中:①托盘天平(带砝码盒);②量筒;③烧杯;④玻璃棒;⑤漏斗;⑥500mL容量瓶;⑦药匙;⑧250mL容量瓶;⑨胶头滴管;⑩坩埚。
A.实验过程中必须用到的仪器除①③④⑦⑨外,还必须要用到: (填写代号)。
B.称量NaOH固体时,应 放在左盘上称量。
(3)实验时该同学操作步骤如下,请将步骤c补充完整。
A.在烧杯中将已称量好的NaOH用蒸馏水充分溶解;
B.将NaOH溶液沿玻璃棒注入所选的容量瓶中;
C. ;
D.振荡,继续向容量瓶中加水直到液面接近刻度线1—2cm处;
E.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
F.将容量瓶盖紧,摇匀。
(4)若称量NaOH固体时,物质和砝码放反了,则所配溶液浓度将 (填“偏大”、“偏小”或“不变”,下同),若进行E操作时仰视则会使所配溶液浓度
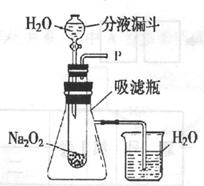 34.(4分)向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。有一化学兴趣小组设计了右图装置进行实验来探究过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
34.(4分)向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。有一化学兴趣小组设计了右图装置进行实验来探究过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[实验探究]实验一:探究反应后生成的气体是什么?
(1)打开右图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃。说明生成的气体是
(2)中,还观察到伸人烧杯中的导管口有气泡冒出,请简述产生该现象的最根本的原因:
实验二:同学们利用所学知识分析,反应后还应有另一种物质生成,于是进行实验,取反应后所得的溶液于另一试管中,滴入无色酚酞试液,发现溶液先变红后褪色,变红说明反应后生成的另一物质是 质存在。 (填化学式);同时溶液中含有一种有 性质的物
五、(本大题包括l小题。共6分)
35.(6分)250mi。某浓度的NaOH溶液恰好与11.2L Cl2 (标准状况)完全反应,计算:
(1)生成的:NaClO的物质的量;
(2)该溶液中NaOH的物质的量浓度。
(3)若该氢氧化钠是用已部分变质为氧化物的钠的单质与水反应来制得的,则所用的该钠的单质未变质时的质量是多少克?
高一化学第一学期期末考试
化学参考答案及评分意见
一、选择题:(共50分)
1.D 2.C 3.C 4.B 5.A 6.C 7.D 8.A 9.B l0.D 11.B 12.B 13.C 14.A 15.B 16.C 17.A 18.B 19.D 20.D 21.D 22.C 23.D 24.B 25.D
二(共14分)
