高一化学第一学期第二次学月考试
化 学 试 卷
本卷分第I卷(选择题)和第II卷(非选择题)。满分100分,考试时间90分钟。
原子量:H:1 Li:7 C:12 N:14 O:16 Na:23 Al:27 S:32
Cl:35.5 K:39 Ca:40 Rb:85 Cs:133 Ba:137
第I卷(共60分)
一、选择题:(本题共30小题,每小题2分,共60分。每小题只有一个选项符合题意)
1.氧化还原反应的实质是
A、有氧原子得失的反应 B、有元素化合价升降的反应
C、有电子的得失或电子对的偏移的反应 D、分子中原子的重新组合
2.物质灼烧时,火焰呈紫色的一定含有 ( )
A.钾原子 B.钾离子 C.钾元素 D.钾的化合物
3.我国化工专家侯德榜所创立的“侯氏制碱法”誉满全球,“侯氏制碱法”的碱是指:( )
A.NaOH B.Na2CO3 C.NaHCO3 D.K2CO3
4.在十七大报告中指出:“建设生态文明,基本形成节约能源和保护生态环境的产业结构、增长方式和消费方式……主要污染物排放得到有效控制。”下列做法符合该指导思想的是( )
A.提倡使用一次性发泡塑料餐具和塑料袋。
B.关闭所有的化工企业。
C.大量使用一次性竹、木筷子以推动林业发展。
D.大量利用垃圾生产燃料、肥料“变废为宝”。
5.物质发生化学变化时,反应前后肯定不发生变化的是 ( )
①电子总数 ②原子总数 ③质子总数
④物质的总质量 ⑤物质的总能量 ⑥物质的种类
A.①②③④⑤ B.①②③④ C.②⑤⑥ D.③④⑤⑥
6.可作为原子反应堆中导热剂的物质是( )
A、Na和Li的合金 B、Na和K的合金 C、金属钾 D、金属铯
7.在下列物质中,长期放置在空气中能发生氧化还原反应的是( )
A、Na2CO3 B、Na2O2 C、NaOH D、CaCl2
8.将一小块金属钠投入到下列物质的水溶液中,既能生成气体又能生成沉淀的是( )
A、NH4Cl B、CuSO4 C、NaNO3 D、BaCl2
9.下列实验操作中错误的是 ( )
A、用规格为10mL的量筒量取6.0mL的液体
B、用药匙或者纸槽把粉末状药品送入试管的底部
C、过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
D、如果没有试管夹,可以临时手持试管给固体或液体加热
10.如果ag某气体中含有分子数为b,则cg该气体在标准状况下的体积是(NA表示阿伏加德罗常数)( )
A、 L B、 L C、 L D、 L
11.能使石蕊试液变红的无色透明溶液中,不能大量共存的离子组是( )
A、Al3+、Ag+、NO3-、Cl- B、Mg2+、NH4+、NO3-、Cl-
C、Na+、K+、NO3-、Cl- D、Zn2+、Na+、NO3-、SO42-
12.阿伏加德罗常数约为6.02×1023mol-1。下列叙述正确的是( )
A、标准状况下,22.4L水中约含有1.204×1024个氢原子
B、常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧原子
C、0.5mol CH4中约含有3.01×1023个电子
D、40g NaOH固体中含有1.204×1024个钠离子
13.下列叙述中正确的是 ( )
A.1 mol任何物质都含有约6.02×1023个原子 B.硫酸的摩尔质量是98 g
C.1 mol N2的质量是28 g D.摩尔是国际单位制中七个基本物理量之一
14.下列状态的物质能导电,且属于强电解质的是 ( )
A.液态H2SO4 B.CH3COOH溶液
C.乙醇的水溶液 D.熔融的NaCl
15.下列关于碱金属元素的叙述正确的是 ( )
A.随着核电荷数的增加,碱金属单质密度逐渐减小
B.碱金属单质的熔、沸点逐渐升高
C.碱金属都能与水反应放出H2
D.随着核电荷数的增加,阳离子的氧化性逐渐增强
16.下列离子方程式正确的是 ( )
A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.钠与水的反应Na+2H2O=Na++2OH -+H2↑
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.大理石溶于醋酸的反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
17.下列各组反应,前后均可用同一离子方程式表示的是 ( )
A.HCl+Na2CO3,HCl+NaHCO3 B.HCl+Na2CO3,NaHSO4+K2CO3
C.H2S+NaOH,H2SO4+KOH D.BaCl2+Na2SO4,Ba(OH)2+NaHSO4
18.下列叙述正确的是 ( )
A.1mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1mol任何物质体积均为22.4L
19.下列说法正确的是 ( )
A.22.4L/mol就是气体摩尔体积
B.非标准状况下,1mol任何气体的体积不可能为22.4L
C.标准状况下,22.4L任何气体都含有约有6.02×1023个分子
D.1molH2和O2的混合气体在标准状况下的体积不一定为22.4L
20.欲除去小苏打溶液中含有的少量苏打杂质,可采用的方法 ( )
A.往溶液中通入足量的CO2 B.加入石灰水
C.加入NaOH溶液 D.加热至沸
21.120℃时,将0.1 mol H2和2.8g CO的混合气体与足量氧气充分燃烧后,立即将所得混合气体通过足量的Na2O2粉末,固体质量增加 ( )
A.2.8 g B.3.0 g C.7.2 g D.4.4 g
22.标准状况下,下列物质的体积最大的是 ( )
A.2 g H2 B.18g 水 C.1.5mol He D.49g H2SO4
23.向酚酞试液中加入过量Na2O2粉末,振荡,下列叙述正确的是 ( )
A.溶液最后变成红色 B.溶液最后褪色
C.有可燃性气体生成 D.无明显现象
24.下列反应中水只作还原剂的是 ( )
A.2Na +2H2O = 2NaOH + H2↑ B.2Na2O2 + 2H2O = 4NaOH + O2↑
C.2F2 + 2H2O = 4HF + O2 D.Cl2 + H2O = HCl + HClO
25.下列各组中的两物质作用时,反应条件(温度、物质的量比)改变,不会引起产物的种类改变的是( )
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.C和O2
26.既是化合反应,又是氧化还原反应的是 ( )
①生石灰加水 ②SO2和氧气生成SO3 ③CO燃烧
④炽热的碳和水蒸汽反应 ⑤钠在氯气中燃烧
A.①②③ B.③④⑤ C.②③⑤ D.①④⑤
27.将12 g由两种金属组成的混合物放入足量的盐酸中,充分反应后收集到H2 0.5 mol,则该混合物不可能是( )
A.Na 和 K B.Li 和 Ca C.Li 和 Rb D.Al 和 Cs
28.将物质的量均为1mol的Na、Mg、Al分别投入含1.825g HCl的盐酸溶液中产生的H2( )
A、一样多 B、Mg最多 C、铝最多 D、镁和铝一样多
29.在反应3Cl2+6KOH=5KCl+KClO3+3H2O中,当有0.5 mol电子转移时,参加反应的还原剂的物质的量为 ( )
A.0.25 mol B.0.5 mol C.0.3 mol D.0.05mol
30.下列物质中指定微粒的数目最少的是 ( )
A.标准状况下11.2 L NH3中的氢原子 B.标准状况下22.4 L 氦气中的氦原子
C.1molH2O中的电子数 D.30g NaOH中的离子总数
高一化学第一学期第二次学月考试
![]() 化 学 试 卷
化 学 试 卷
第II卷(共40分)
31.(4分)标准状况下,67.2L NH3气体中含有的分子数为 ,质量为 g,
与 g O2所含的原子数目相同;将这些NH3气体全部溶于水配成250mL溶液,该溶液的物质的量浓度为 mol/L。
32.(6分)已知2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O,则该反应中
氧化剂 还原剂 氧化产物 还原产物
反应中若有71克Cl2生成,则被氧化的HCl的物质的量 mol,转移的电子的物质的量为 mol。
33.(8分)①钠在空气中燃烧,火焰呈 色,生成 色的固体。在120℃时,将12.4gCO2和H2O的混合气体缓缓通入过量该产物固体中,充分反应之后,固体的质量增加6g,产生氧气的质量为 g。
②将4.48L(标准状况)的CO2和CO的混合气体通入盛有过量该产物固体的密闭容器中,不断用电火花引燃,充分反应后剩余1.12L气体(标准状况),则:原混合气体中CO2和CO的体积比为 ,原混合物的平均相对分子质量为 。
34.(4分)H2S是弱电解质,写出可用于描述反应2FeC13+H2S=2FeC12+S↓+2HC1的离子方程式: ;若生成a g 硫,电子转移总数为b个,则阿佛加德罗常数可表示为 。
|
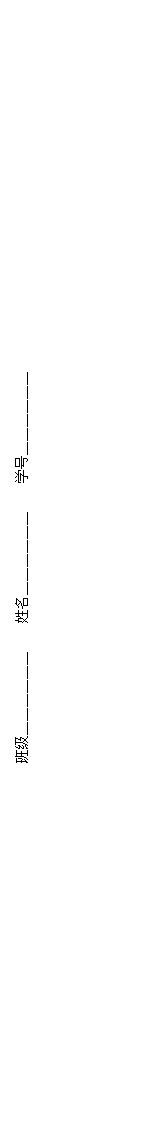
(1)分别写出下列化学方程式:
A→C: ;
C→E: ;
D→E: 。
(2)分别写下列离子方程式:
D→G: ;
G→H: ;
H能溶于盐酸生成一种能使澄清石灰水变浑浊的气体:
。
36.(6分) 标准状况下,一个装满氧气的容器质量为74 g,若装满氮气时质量为66 g,盛满某气体X时,质量为152g。试计算:(须有必要的计算过程)
(1)此容器的容积。 (2)气体X的相对分子质量。
高一化学第一学期第二次学月考试
化 学 答 案
第I卷(共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| C | C | B | D | B | B | B | B | D | A | A | B | C | D | C |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| D | B | C | C | A | B | C | B | C | C | C | A | D | D | B |
第II卷(共40分)
31、32、每空1分;33、前两空每空1分,后三空每空2分;34、35、每空2分。
(书写方程式时,如化学式写错、未配平均不给分,未写条件和↑↓酌情扣分)
31.3NA(1.806×1024) 51 192 12
32.KMnO4 HCl Cl2 MnCl2 2 2
33.①黄 淡黄 6.4 ②1:1 36
34.2Fe3++H2S=2Fe2++S↓+2H+ 16b/a
35.(1)A→C:2Na+O2![]() Na2O2 C→E:2Na2O2+2CO2=2Na2CO3+O2
Na2O2 C→E:2Na2O2+2CO2=2Na2CO3+O2
D→E:2NaOH+CO2=Na2CO3+H2O
(2)D→G:OH—+CO2=HCO3— G→H:HCO3—+Ca2++OH—=CaCO3↓+H2O
CaCO3+2H+=Ca2++ CO2↑+H2O
36.(1)44.8L ……3分 (2)71 ……3分。
容器容积的求解方法提示:
差量法
标准状况下,22.4LO2与22.4L N2的质量差为32g-28g=4g,
此题中O2与N2的质量差为74-66=8g,依此可得:
设瓶的容积为x 有:
O2 ~ N2 △m
22.4L 4g
x 8g
算出 x=4.48L