高一化学第一学期第二次月考试题
化学试题
命题、审核:刘振国 常国福
第一卷 (选择题共50分)
时量100分钟,满分100分,请考生把选择题答案填入答题卡内。
可能用到的相对原子质量:H:1 He:4 C:12 N:14 O:16 S:32 CI:35.5 Na:23 Mg:24 K:39 Fe:56
一、选择题(每小题只有1个选项符合题意,2分×25)
1、北京市成为2008年第29届夏季奥运会的举办城市。为向世界展现一个新北京的形象,有关部门提出下列建议:①开发新能源,减少化石燃料的燃烧;②分类回收垃圾;③限制使用塑料袋和一次性塑料餐具;④提倡使用手帕,减少餐巾纸的使用;⑤农业上控制化肥和农药的使用。你认为可以采纳的是
A.①②③④ B. ①②④⑤ C. ②③④⑤ D. 全部
2.人们在认识事物时可以采取多种分类方法。下列关于纯碱的分类不正确的是
A.化合物 B.碱类 C.钠盐 D.碳酸盐
3、下列叙述中正确的是
A.摩尔是物质的质量的单位 B.碳的摩尔质量为12g
C.阿伏加德罗常数约为6.02×1023mol-1 D.气体摩尔体积为22.4L/mol
4.在配制2.0mol/L NaCl溶液的实验中,必须使用的仪器是
![]()
![]()
![]()
![]()
A B C D
5.下列反应中,属于氧化还原反应的是
A.2Na+2H2O ══ 2NaOH+H2↑ B.2Fe(OH)3══ Fe2O3+ 3H2O
C.SO2+H2O![]() H2SO3 D.Cu(OH)2+2HCl
══CuCl2+2H2O
H2SO3 D.Cu(OH)2+2HCl
══CuCl2+2H2O
6.下列反应中,盐酸既表现出酸性又表现出还原性的是
A.MnO2 + 4HCl(浓)══ MnCl2 + Cl2↑+ 2H2O B.HCl + AgNO3 =AgCl↓+ HNO3
C.Zn + 2HCl = ZnCl2 + H2↑ D.2HCl ══ H2↑+ Cl2↑
7.下列关于容量瓶的使用方法中,正确的是
A. 在容量瓶中可直接稀释浓硫酸
B. 在容量瓶中可直接溶解氢氧化钠固体
C. 溶液不必冷却至室温即可注入容量瓶中
D. 向容量瓶中转移溶液时,需要用玻璃棒引流
8.下列物质中含有自由移动的Cl-是
A.KClO3溶液 B.KCl溶液 C.液态HCl D.NaCl固体
9、下列关于气体体积的叙述中,正确的是
A.一定温度和压强下,各种气态物质体积的大小,主要由构成气体的分子大小决定。
B.不同的气体,若体积不同,则它们所含的分子数也不同。
C.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定。
D.相同物质的量的气体,它们的体积一定相同。
10、若下列物质均为1g,则含分子数最多的是( )
A.CH4 B.N2 C.NO D.CO2
11、NA代表阿伏加德常数,下列说法正确的是 ( )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.2g氢气所含原子数目为NA
C.在常温常压下,11.2L氮气所含的原子数目为NA
D.17g NH3所含电子数目为10NA
12、在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为( )
A.1:1:1 B. 1:2:3 C.3:2:1 D.6:3:2
13、把2.3g钠完全燃烧,所得浅黄色粉末与足量的CO2反应,所生成的气体的体积(标准状况)是( )
A.112mL B.336mL C.500mL D.560mL
14.在实验室中,对下列实验、事故或药品的处理正确的是
A.加热液体的试管口不能正对着自己或别人
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D.含硫酸的废液倒入水槽,用水冲入下水道
15.某气体的摩尔质量为Mg·![]() ,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则
,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则![]() 表示的是( )
表示的是( )
A.VL该气体的质量(以g为单位) B.1mol该气体的体积(以L为单位)
C.1L该气体的质量(以g为单位) D.1L该气体中所含的分子数
16.将2.3g金属钠投入到足量水中,得到a g溶液;2.4g金属镁投入到与水等质量的足量盐酸中,得到b g溶液,则a、b的关系为( )
A.a=b B.a<b C.a>b D.无法确定
17.混合气体由CO和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中CO和CH4的体积比为( )
A.1:1 B.1:4 C.4:1 D.1:2
18.关于Na的描述正确的是( )
①Na在自然界既有游离态又有化合态存在 ②金属Na着火可以用泡沫灭火器救火 ③实验室中少量的Na保存在煤油里 ④Na-K合金做原子反应堆的导热剂 ⑤Na比Cu活泼,因而Na可以从CuCl2溶液中置换出Cu ⑥Na在空气中燃烧,主要产物是Na2O2
A.①③④⑤⑥ B.③④⑥ C. ③④ D.全部
19、浓度为Cmol·L-1的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有H+( )
A.0.001Cmol B.0.002Cmol C.0.005Cmol D.0.005mol
20、同温同压下,3体积A2气体跟1体积B2气体完全反应生成2体积C气体,则它的化学式是( )
A、A2B B、AB2 C、BA3 D、B3A
21. 血红蛋白的相对分子质量约为68000, 已知其中含铁0.33%, 则平均每个血红蛋白的分子中铁原子数为
A、5 B、4 C、3 D、2.4×1024
22. 将溶质质量分数为a%,物质的量浓度c1mol/L的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数为2a%,此时物质的量浓度为c2mol/L.则c1和c2的关系是( )
A.c2 = 2c1 B.c2 >
2c1
C.c1<2c2
D.无法估算
23. 今有H2、CO(体积比为1:2)的混合气体VL,当其完全燃烧时所需O2体积为
A. 3VL B. 2VL C. VL D. 0.5VL
24. 下列离子方程式书写正确的是( )
A.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
D.碳酸钠与盐酸等物质的量反应:CO32-+H+= HCO3-
25.在NaCl、MgCl2、MgSO4三种盐配制的混合液中,Na+为0.1 mol, Mg2+为0.25 mol,Cl— 为0.2 mol,则SO42 - 为
A、0.5 mol B、0.15 mol C、0.25 mol D、0.2 mol
—————————————————————————
以 下 为 草 稿 纸
高一化学第一学期第二次月考试题
化学试题
第一卷答题卡:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | # |
| 答案 | # |
第二卷 (共50分)
二、填空题(18分)
26、(3分)碳与浓硝酸可发生反应:C + 4HNO3 = CO2↑ + 4NO2↑+ 2H2O 。在该反应中,作为氧化剂的物质是 (填化学式),作为还原剂的物质是 (填化学式);若反应中生成了1 mol CO2,则需消耗 mol HNO3 。
27.(4分)某无色溶液由①K+、②Cl-、③CO32-、④SO42-中的若干种离子组成。取部分该溶液,分装在四支试管中,分别进行实验:
(1)进行焰色反应,透过蓝色钴玻璃观察火焰呈紫色,说明一定含有的离子是
(填序号,下同)。
(2)滴加盐酸溶液,有气泡产生,说明一定含有的离子是 。
(3)加入少量稀硝酸使溶液酸化,再加入硝酸钡溶液,无白色沉淀产生,说明一定不含有的离子是 。
(4)加入少量稀硝酸使溶液酸化,再加入硝酸银溶液,产生白色沉淀,说明一定含有的离子是 。
28.(4分)4g NaOH溶解在水中,要使Na+离子数与水分子数之比为1:100,则需水的物质的量为 mol,其溶液中有 mol OH-,中和这些OH-,需要 mol H+,需要 g H2SO4。
29.(4分)(1)0.3moLNH3中所含的原子数与 moLH2S所含原子数目相等。
(2)2moLNa2CO3中含有的Na+离子数目是 moL。
(3)100gO2和100gO3所含原子个数比为 ;
(4)若1个篮球的容积为11.2 L,其所能容纳的标准状况下的空气里含有
个分子。
30.(3分)19g某二价金属的氯化物ACl2中含有0.4mol Cl--,ACl2的摩尔质量是 g/mol,A的相对原子质量是 ,A元素的名称为
三简答与推断(11分)
31. A、B、C、D、E五种物质的焰色反应都显黄色。A、B与水反应都有气体产生,A与水反应放出的气体具有氧化性,B与水反应放出的气体具有还原性,同时都生成C的溶液。C与适量的CO2反应生成D,D的溶液与过量的CO2反应生成E的溶液,E加热变D。请填写下列空白:
(1)A与水反应的化学方程式_____________________________
(2)B与CuSO4溶液反应的化学方程式:
_______________________________________
(3)以D和另一种常见的试剂在实验室制得少量C的化学方程式:
。
32、碳酸氢钠是一种细小的白色晶体,碳酸钠是一种白色粉末,根据它们的性质填空:
①在水中的溶解度(同温) 较大;
②热稳定性: 较稳定;
③与酸反应放出CO2 较剧烈;
④等物质的量的两种物质与盐酸(足量)反应 消耗的盐酸多;
⑤等质量的两种物质与足量的盐酸反应放出的CO2气体 多。
四、实验题(13分)
33.(7分)某同学配制500mL 0.200mol·L—1NaOH溶液有如下操作步骤:
①把称量好的NaOH固体放入小烧杯,加适量蒸馏水溶解:
②把①所得溶液小心转入500mL容量瓶中:
③继续向容量瓶中加蒸馏水至液面距刻度线1-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞塞紧,充分摇匀,将溶液转移至试剂瓶并贴上标签。
请填写下列空白:
(1)需要称量NaOH固体 g。
(2)操作步骤的正确顺序为(填序号) 。
(3)本实验用到的玻璃仪器有:烧杯、玻璃棒、 。
(4)若实验过程中出现如下情况,应如何处理?
①加蒸馏水时不慎超过了刻度线: 。
②向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面。 。
(5)下列操作对所配溶液的浓度有何影响?(偏高,偏低,无影响)
①在未降至室温时,立即将溶液转移至容量瓶定容: 。
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度: 。
34、(6分)按以下装置图进行实验,填写有关现象及化学方程式
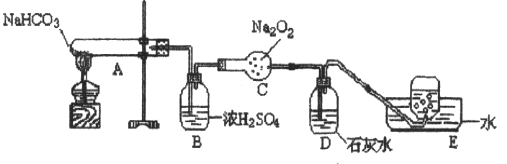
(1)A中现象是_______________________________________________,
(2)B中浓硫酸的作用是_______________________________________,
(3)C中发生反应的化学方程式为_______________________________,
(4)D中现象是___________,反应的离子方程式是_______________ ,
(5)E中收集的气体是_______________。
五、计算题(每个计算题都有A、B两个小题,请任选一题作答,若两小题都做,以A小题为准。8分)
35.(4分)A、制取500g质量分数为14.6%的盐酸,需要标准状况下HCl气体的体积是多少 若所得溶液的密度为1.10g/mL,则所得溶液的物质的量浓度是多少
B、将溶有标准状况下1.12L HCl气体的盐酸与足量的AgNO3溶液充分反应。试计算(最后结果精确至0.01):
(1)生成AgCl的物质的量为多少?
(2)生成AgCl的质量为多少?
36、(4分)A、现有等物质的量的NaHCO3和KHCO3的混合物ag与100mL盐酸反应。题中涉及的气体体积以标准状况计,填空时可以用带字母的分式表示。
(1)该混合物中NaHCO3和KHCO3的质量比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为 mol·L-1
(3)如盐酸过量,生成CO2体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需知道 。
B、标况下,向10L由H2、CO2、CO、N2组成的混合气体中通入6L
O2,用电火花引燃,使之充分反应后,测得气体体积为7.5L,将这些气体通过盛有过量NaOH溶液的洗气瓶,气体体积变为2L,这2L气体的密度是相同状况下H2密度的15.5倍。求原混合气体中各种气体的体积。
化学试题参考答案
第一卷答题卡:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | B | C | A | A | A | D | B | C | A | D | D | D |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | # |
| 答案 | A | C | A | C | B | C | C | B | B | D | D | D | # |
二、填空题:
26 、HNO3 、C 4 27、①K+、③CO32-、④SO42-、②Cl-、
28、10、0.1、0.1、4.9 29、0.4、4、1:1、0.5NA
30、95、24、镁
三、简答与推断:
31、2Na2O2 + 2H2O =4 NaOH + O2↑ 2Na + 2H2O + CuSO4 = Na2SO4 + Cu(OH)2↓ + H2↑
Na2CO3 + Ca(OH)2 = CaCO3↓+2 NaOH
32、Na2CO3、Na2CO3、NaHCO3、Na2CO3、NaHCO3
四、实验题:
33、(10分)
(1) 4.0 g。(2)(填序号) ①②④③⑤ 。(3) 500mL容量瓶,胶头滴管
(4)① 重新配制 。② 重新配制 。(每空1分)(5)偏高 偏低
34、(1) 试管内壁有无色液滴,
(2) 干燥气体、(吸收H2O),(3) 2Na2O2 + 2CO2 = 2Na2CO3 + O2,
(4) 石灰水变浑浊 CO2 + Ca2+ + 2OH- = CaCO3↓+ H2O,(5) O2
五、计算题(共8分)
35.(4分)解: HCl + AgNO3 == AgCl↓ + HNO3 ………………1分
22.4 L 1mol
1.12L n (AgCl) ……………………1分
(1)n (AgCl)= ![]() ………………………………1分
………………………………1分
(2)m (AgCl) = 0.05 mol×143.5 g / mol = 7.18 g …………………1分
36、(1)84∶100 (2) 5a/46(3)22.4a/92或5.6a/23 (4)盐酸的物质的量浓度