高一化学第一章单元测试题
姓名 班级 得分
一.选择题(每小题只有一个正确选项,每小题2分,共60分)
1. 据报道,1994年兰州近代物理研究所研制出首批氧-18气体.氧-18(18O)又称重氧,下列有关叙述正确的是(NA表示阿伏加德罗常数) ( )
A. 11.2 L重氧所含分子数为0.5NA B. 32g重氧气体所含原子数为2NA
C. 2g重氧水(H218O)所含中子数为NA D. 1.8g重氧气体的物质的量为0.1mol
 2.下列叙述正确的是( )
2.下列叙述正确的是( )
A.40 K和40 Ca原子中的质子数和中子数都相等
B.某元素最外层只有一个电子,则它一定是ⅠA族元素
C.任何原子或离子的组成中都含有质子
D.同位素的不同核素物理、化学性质完全相同
3.下列物质的电子式, 正确的是 ( )![]()
4.元素X的原子获得3个电子和元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确的化学式为( )
A.Y3X2 B.X2Y2 C.X3Y2 D. Y2X3
5. 比较S2-和S的性质,下列叙述正确的是: ( )
A.S2-只具有还原性而S只具有氧化性 B.S2-和S都是不溶于水的淡黄色固体
C.S2-半径比S大,但氧化性S大于S2-
![]() D.它们在空气中都一定能燃烧且都能生成具有刺激性气味的气体
D.它们在空气中都一定能燃烧且都能生成具有刺激性气味的气体
6.
( )  A. ③②①④ B. ③④①② C. ②④③① D. ②④①③
A. ③②①④ B. ③④①② C. ②④③① D. ②④①③
7. 同温同压下,体积相同的两个容器中,分别充满由14N、13C、18O三种原子构成的一氧化氮(14N18O)和一氧化碳(13C18O).下列说法正确的是 ( )
A.所含分子数和质量均不相同 B.含有相同的质子和中子
C.含有相同的分子数和电子数 D.含有相同数目的中子、原子和分子
8. X和Y均为短周期元素,两者组成化合物X3Y2, 若Y的原子序数为m,则X的原子序数不可能是:
A. m+6 B. m+5 C. m-3 D. m-11
9.下列各组中化合物的性质比较,不正确的是 ( )
A.酸性:HClO4>HBrO4>HIO4 B.稳定性:PH3>H2S> HCl
C.碱性:NaOH>Mg(OH)2>Al(OH)3 D.非金属性:F>O>S
10.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断 ( )
A.R一定是第四周期元素 B.R一定是ⅣA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定 D.R气态氢化物化学式为H2R
11. 已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为
|
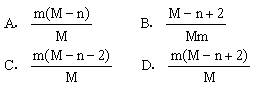 第15题图
第15题图
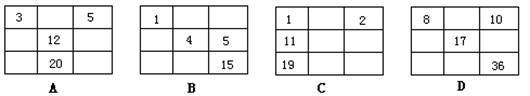
12.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是 ( )
13.第119号未知元素,有人称为“类钫”。根据周期表结构及元素性质变化规律,下列有关“类钫”的说法中错误的是( )
A.灼烧氯化“类钫”时,火焰有特殊颜色 B.硝酸“类钫”是离子化合物,易溶于水
C.“类钫”具有放射性 D.“类钫”单质的密度小于1g/cm3
14.两种微粒的质子数和电子数均分别相等,它们不可能是 ( )
A. 一种阳离子和一种阴离子 B.一种单质和一种化合物分子
C.两种分子之间 D.一种原子和一种分子
15.右上图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是 ( )
A. B为第二周期的元素 B. C为VA族元素
C. 三种元素不都为非金属元素 D. C是化学性质最活泼的非金属
16. 下列化合物中阳离子半径与阴离子半径之比最大的是( )
A. LiI B.NaBr C.KCl D.CsF
17.下列各组物质中化学键的类型相同的是( )
A HCl MgCl2 NH4Cl B H2O Na2O CO2
C CaCl2 NaOH H2O D NH3 H2O CO2
18.下列变化过程中,共价键被破坏的是( )
A. 烧碱溶于水 B.氯化氢气体溶于水 C.二氧化碳变成干冰 D.碘溶于酒精
19.电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是( )
A. CO和CO2 B. NO和NO2 C. CH4和NH3 D. CO2和SO2
20.X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是 ( )
A. R 一定是共价化合物 B. R一定是离子化合物
C. R可能是共价化合物,也可能是离子化合物 D. R可能是气态物质,也可能是液态物质
21.已知A、B、C三种短周期元素可以形成化合物AB2、CA2,则A一定为( )
A.金属元素 B.非金属元素 C.IA族元素 D.IVA族元素
22.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>D>C B. 原子序数:d>c>b>a C. 离子半径:C>D>B>C D. 原子的最外层电子数目:A>B>D>C
23.某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
A. H2XO3 B. HXO3 C. H3XO4 D. H2XO4
24.下列分子中所有原子都满足最外层为8个电子结构的是( )
A.BF3 B.SiCl4 C.H2O D.PCl5
25.下列关于1H、2H、3H、H+ 说法正确的是( )
A.化学性质不同的氢原子 B.同一种氢原子 C.氢的四种同位素 D.氢元素的不同微粒
26.某种元素R的核外电子数等于核内中子数,取该元素5.6g跟氧气充分反应,可得到12g化合物RO2,则该种元素R在周期表中的位置是:( )
A、第二周期第ⅣA族 B、第三周期第ⅣA族C、第三周期第ⅥA族D、第二周期第ⅥA族
27.根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Fe3++2Br-,判断下列离子的还原性由强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
28.A、B、C、D为四种短周期元素,已知A、C同族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层,下列叙述不正确的是( )
A.原子序数:A>B>D>C B.单质熔点:D<B,C>A
C.原子半径:D>B>C>A D.简单离子半径:C>A>D>B
29..实验室用一种准确的仪器来分别测定一个氢分子的质量时,所得的数值可能是:( )
A.3种 B.4种 C. 5种 D.6种
30.两种元素原子的核外电子层数与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有( )
A.1对 B.2对 C.3对 D.4对
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、填空题(本题共4道小题,共33分。)
31.(7分)A、B、C三元素原子的核外电子数都比氩原子少,A和C处于同主族,两者间隔一周期, A元素和B元素的原子两者核电荷数之差为5, B原子核外第3电子层比第2电子层少两个电子, 则B的原子结构示意图为_________;B与C形成化合物的化学式是_____,它的电子式是 它属于 化合物(填“离子”或“共价”);A与B形成化合物的化学式是 , 它的电子式是 ,它属于 化合物。
32(2分).已知硼有两种同位素原子10B和11B,若硼的相对原子质量为10.8,则10B的质量百分含量为 。
33(8分).W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素的质子数之和的3倍。上述元素中任意三种可组成碱或盐,写出这些盐的化学式(至少写四种): 、 、 、 。四种元素中两两组合,能生成共价化合物的化学式有(至少写四种): 、 、 、 。
34.(8分)有A、B、C、D、E五种主族元素,其原子的最外层电子数依次为1、3、7、6、4,原 子序 数按E、B、D、C、A的顺序依次增大.D的最高价氧化物的式量与气态氢化物的式量之比为2. 35∶1,且该原子核内质子和中子相等,A、B、C原子的次外层都有8个电子,E原子的次外层有2 个电子.
(1)计算D的原子量 ;
(2)写出元素符号:A、 B、 C、 D、 E、 ;
(3)按酸性由强到弱、碱性由弱到强的顺序写出它们最高价氧化物对应水化物的化学式 ;
(4)A和B两元素的最高价氧化物对应水化物相互反应的离子方程式为:
35(11分).动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体。 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
① ,② ,
③实验结论: , 。
三.计算题.
36.(4分)2.8g某单质A能从盐酸中置换出0.1g H2,同时生成ACl2;另一元素B,它的最高价氧化物的化学式为BO3。在B的氢化物中,B的质量分数为94.1%。
计算A、B两种元素的相对原子质量。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| C | C | C | C | C | A | D | A | B | D | D | D | D | A | D |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| D | D | B | C | C | B | C | D | B | D | B | B | A | C | B |
31.(7分)![]() ; H2S,
; H2S, ![]() 共价; Na2S ,
共价; Na2S , ![]() 离子 。
离子 。
32. 略小于20%
33.(8分) NaOH. Na2SO4 . Na2SO3 .NaHS
H2O . H2S . SO2 . SO3
34. (8分) (1)32
(2)K、Al、Cl、S、C
(3)HClO4、H2SO4、H2CO3、Al(OH)3、KOH
(4)Al(OH)3 + 2OH- == AlO2- + 2 H2O
35.(11分)(1) (1分)同周期 (2) (3分)试管、烧杯、酒精灯
(3) (3分)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象 | B | F | A | C | D | E |
①(1分)Mg+2H2O![]() 2Mg(OH)2+H2↑ ②(1分)Na2S+Cl2 =2NaCl+S↓
2Mg(OH)2+H2↑ ②(1分)Na2S+Cl2 =2NaCl+S↓
|
36. A、B两种元素的相对原子质量分别为56、 32。