高一化学第三次月考试卷
命题人:刘尊伟
姓名___________班级___________学号___________成绩___________
可能用到的相对原子质量:H:
一、选择题(本题包括20小题,每小题只有一个正确答案)
1.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。那么一个铅笔字含有的碳原子数约为
A、2.5×1019个 B、2.5×1022个 C、5×1019个 D、 5×1022个
2. Fe(OH)3胶体和MgCl2溶液共同具备的性质是
A.都比较稳定,密封放置不产生沉淀 B.都有丁达尔现象
C.加入盐酸先产生沉淀,随后溶解 D.分散质粒子可通过滤纸
3. 某无色溶液能和Al反应放出H2,在该溶液中可能大量共存的离子组是
A. Fe2+、NO3-、Cl- B.Na+、OH-、NO3-
C. Na+、SO42-、HCO3- D.H+、SiO32-、Cl-
4.两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的
A.质子总数 B 电子总数 C 分子总数 D 质量
5.用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
A.铝在空气中能很快形成氧化膜 B.铝箔表面温度低,未熔化
C.氧化铝的熔点比铝高 D.氧化铝薄膜包住了熔化的铝
6. 有关硅及其化合物的下列叙述中正确的是
A.二氧化硅与任何酸都不反应
B.二氧化碳通入水玻璃中能得到硅酸
C.硅的性质很稳定,能以游离态存在于自然界
D.二氧化硅溶于水显酸性
7.电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中……假如潘冬子在实验室中,欲从食盐水中提取出食盐,最好采用的方法是
A.过滤 B.萃取 C.蒸发 D.蒸馏
8.纯铁的熔点为
A.铁的纯度越高熔点越低 B.合金的熔点比其成分物质的熔点高
C.因为形成了铁碳合金,所以熔点变低 D.在高炉中熔化的过程中发生了化学反应
9.已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于
A.蒸馏 B.分液 C.过滤 D.蒸发
10. 设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,
B.标准状况下,
C.
D.标准状况下,含NA个He原子的氦气所占的体积约为
11. ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: 2KClO3+H
A.KClO3在反应中失去电子 B.ClO2是氧化产物
C.1
molKClO3参加反应有2mol电子转移 D.H
12.有关Na2CO3和NaHCO3的性质,下列叙述中错误的是
A.等质量的Na2CO3和NaHCO3分别与足量的盐酸反应时,在相同条件下Na2CO3比NaHCO3产生的气体体积小
B.常温时水溶性:Na2CO3> NaHCO3
C.等物质的量的Na2CO3和NaHCO3跟同一种盐酸充分反应时,消耗酸的体积之比是2∶1
D.将澄清的石灰水分别加入Na2CO3和NaHCO3溶液时,前者产生沉淀,后者不产生沉淀
13. 用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是
A.漂白粉被氧化了
B.有色布条被空气中的氧气氧化了
C.漂白粉跟空气中的 CO2反应充分,生成了较多量的 HClO
D.漂白粉溶液蒸发掉部分水,其浓度增大
14. 据东方网消息:
①及时转移疏散人群,向有关部门如实报告事故有关情况;②被转移人群应戴上用浓NaOH溶液处理过的口罩;③用高压水枪向空中喷洒含碱性物质的水溶液;④被转移人群可戴上用皂肥水打湿的口罩;⑤将人群转移到地势较低的地方即可,不必走太远;⑥及时清理现场,检查水源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
A.②③④⑤ B.①③④⑥ C.①②⑤⑥ D.①③⑤⑦
15.NaCl、MgCl2、AlCl3三种溶液的体积比为3∶2∶1,分别与等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是
A.1:2:3 B.3:4:
16.下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉:![]()
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
17.制印刷电路时常用氯化铁溶液作“腐蚀液”,发生的化学反应为2FeCl3+Cu==2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁B.烧杯中有铁无铜C.烧杯中铁铜都有D.烧杯中铁铜都无
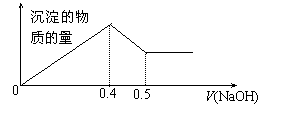 18. 现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,
18. 现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,
得到沉淀的量与加入NaOH溶液的体积如图所示,
原溶液中Cl-与SO42-的物质的量之比为
A.1 :3 B.2 :3
C.6 :1 D.3 :1
19.实验室用MnO2与浓盐酸共热制Cl2,当有14.6HCl被氧化时,将Cl2全部用消石灰吸收,可得漂白粉
A、14.3g B、25.4g C、28.6g D、50.6g
20.把7.4 g Na2CO3·10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液,其中c(Na+)=0.6mol/L。若把等质量的混合物加热至恒重,残留物的质量是
A.3.18g B.2.12g C.4.22g D.5.28g
二、实验题
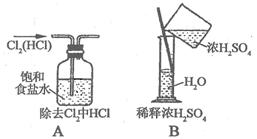
21.下列各图所示的实验原理、方法、装置和操作正确的是 (填序号)
22.请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(1)按气体从左向右流向将各装置依次连接起来(填接口标号):
a 接 , 接 , ,_ 接 , 接_ 接_ 。
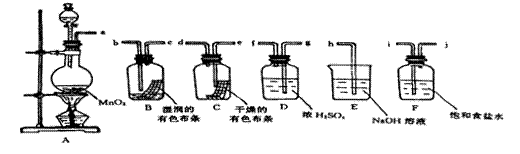
(2)烧瓶中发生反应的化学方程式是 。
(3)D装置的作用 ,E装置的作用 ,F装置的作用 。
(4)C瓶中的现象是 B瓶中的现象是 。
以上事实说明起漂白作用的物质是 。
23. 对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1) 现有下列五种物质:CO2、SiO2、CaO、Al2O3、Fe3O4。按照不同的分类标准,它们中有一种物质与其他四种有明显的不同,请找出这种物质,并写出分类的依据。(至少要写出二种分类方法)①_________ _,______________________________;
② _____,______________________________。
(2) 从反应中有无离子参加,可以将反应分为离子反应和非离子反应。从反应中_____ ______可以将反应分为氧化还原反应和非氧化还原反应;虽然分类的方法不同,但它们之间也存在着一定的关系。你认为离子反应与氧化还原反应的关系是___________(填序号)
①离子反应全部是氧化还原反应 ②离子反应都不是氧化还原反应
③离子反应有的是氧化还原反应,有的是非氧化还原反应
用离子反应方程式证明你的观点:__________ ___ ______,_____ ______________。
三、填空题
24.用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
(1)计算机芯片的主要成分是 (填元素名称);
(2)光导纤维的主要成分是 (填成份的名称):
(3)目前应用最多的太阳能电池的光电转化材料是 (填化学式);
25.常温下,下列物质: ⑴Na ⑵液氯 ⑶Na2O ⑷CaCO3 ⑸CO2 ⑹SO3 ⑺NH3 ⑻酒精
⑼HCl ⑽H2SO4 ⑾Ba(OH)2 ⑿NaCl ⒀蔗糖 ⒁NaCl溶液。(填序号)
①属于电解质的是 ,
②属于非电解质的是 ,
③溶于水能导电的是 。
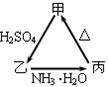 26.甲、乙、丙三种物质之间有如右图所示的转化关系:
26.甲、乙、丙三种物质之间有如右图所示的转化关系:
⑴ 若甲是不溶于水的白色固体氧化物,但既能溶于硫酸又能溶于氢氧化钠溶液,写出下列转化的方程式:
乙→丙的离子方程式______________________________________,
丙→甲的化学方程式______________________________________。
⑵ 若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是_______________(写化学式)
甲→乙的离子方程式是________________________________________________。
27.向Fe2O3固体粉末中加入200mL 3mol/L的盐酸,固体粉末恰好完全溶解。向所得溶液中加入一定量铁粉,此时向溶液中滴加KSCN溶液,无明显现象。试计算:
⑴Fe2O3的物质的量是 moL ⑵加入铁粉的质量至少为 g。
四、计算题
28.实验室用 17.4g MnO2与足量的浓度为12mol/L的浓盐酸反应制取氯气。
(1) 产生的Cl2在标准状况下的体积为多少? (2)理论上被氧化的HCl的物质的量为多少?
(3) 为什么实际操作中所需的浓盐酸比理论中要多?
(4) 若将反应后的溶液配制成500mL溶液,则该溶液中MnCl2的物质的量浓度是多少?
29. 今有Na2C03、NaHC03和NaCl的混合物100 g,加热到质量不再减少为止,其剩余残渣为84.5 g;将残渣溶于水,滴入足量AgN03溶液得到白色沉淀,加足量稀硝酸后大部分沉淀消失,剩余沉淀为12.26 g。则混合物中Na2C03、NaHCO3和NaCl的质量分数各是多少?
参考答案:
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | D | B | C | B | B | C | C | A | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | D | C | B | D | D | A | C | B | A |
二、实验题:
21、A
![]()
![]() 22、(1)、g、f、i、j、e、d、b、c、、h
22、(1)、g、f、i、j、e、d、b、c、、h
(2)、MnO2 +4HCl(浓)===MnCl2+2H2O+Cl2
(3)、a、除去氯气中的 水蒸气
b、吸收尾气,防止大气污染
c、除去氯气中的HCl
(4)、干燥的有色布条不褪色 湿润的有色布条褪色 HClO
23、(1)①CO2 CO2为气体氧化物
②Al2O3 Al2O3为两性氧化物
(2)有无电子转移 ③ H++OH-=H2O Fe +Cu2+=Cu+Fe2+(只要符合题意均得分)
三、填空题
24.、(1)硅(2)二氧化硅(3) Si
25、①3、4、9、10、11、12
②5、6、7、8、13
③1、2、3、5、6、7、9、10、11、12、14
26、(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4+、2Al(OH)3=Al2O3+3H2O
(2)Fe2O3、Fe2O3+6H+=2Fe3++3H2O
27、(1)0.1 (2)5.6
四、计算题:
28、(1)、4.48L
(2)0.4mol
(3)因为HCl会挥发,而且二氧化锰与稀盐酸反应不反应产生氯气
(4)0.4mol/L
29、26.5%
42%
31.5%