高一化学物质结构元素周期律测试单元复习提纲
英德中学高一化学备课组
一、原子结构、核外电子排布规律
1.据报道,某些不合格大理石装潢材料中含有的放射性同位素氡![]() 严重超过规定标准,对人体造成伤害。该同位素原子中的中子数与核外电子数之差为 。
严重超过规定标准,对人体造成伤害。该同位素原子中的中子数与核外电子数之差为 。
2.下列各组中互为同位素的是 。
A.![]() 与
与![]() B.T2O与H2O C.
B.T2O与H2O C.![]() 与
与![]() D.金刚石与石墨
D.金刚石与石墨
3. A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n > m ,则下列关系正确的是
A.a > b > c B. a > c > b C.a = b + m + n D.a = c – n - m
(深化备选题)A Xn+共有x个电子,则X的质子数为 ,中子数为 ;已知A Xn—共有x个电子,则mg A Xn—所含中子的物质的量是 mol。
4、氯元素的天然同位素有35Cl 和37Cl 。氯元素的相对原子质量为35.5,则天然氯元素中35Cl 和37Cl的原子数目之比为 。
(深化备选题)已知C有12C、13C、14C三种同位素,O有16O、17O、18O三种同位素,则可形成 种二氧化碳分子,形成的二氧化碳的相对分子质量最多有 种。
5.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是
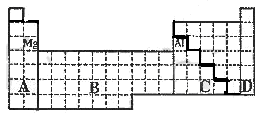
A 电子数 B 最外层电子数 C 电子层数 D 次外层电子数
6.下面叙述正确的是
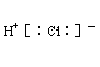
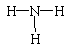 A、一个D2O分子所含的中子数为8 B、NH3的结构式为
A、一个D2O分子所含的中子数为8 B、NH3的结构式为
C、HCl的电子式为 D、Ar原子的结构示意图为![]()
7.某电子层当它作为最外层时,最多只能容纳8个电子,当它作为次外层时,最多只能容纳18个电子,该电子层可能是
A.M层 B.K层 C.L层 D.P层
8.写出10电子和18电子微粒各10种:
二、元素周期律、元素周期表
9.1869年,俄国化学家 按 的递增编制了第一个较完整的元素周期表。
10.元素周期表中目前有 个横行 个周期,周期序数= ;短周期为 ,每周期分别有 种元素;长周期为 ,每周期分别有 种元素;不完全周期为 ,目前有 种元素,排满有 种元素。
11.元素周期表中有 个纵行 个族,包括 个主族 个副族,还有 族和 族。主族序数= 。
12.不查元素周期表,请指出35和116号元素在周期表中的位置: 、
。
13.请写出所有主族元素和稀有气体的元素符号、名称和原子序数:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
14.元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
15.同一周期,从左到右,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,
金属性逐渐 ,非金属性逐渐 ;同一主族,从上到下,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,金属性逐渐 ,非金属性逐渐 .
16.主族元素的最高正价= = = ( 、 除外);非金属元素最低负价= 。以R代表第ⅣA、ⅤA、ⅥA、ⅦA族的非金属元素,写出它们的气态氢化物的通式: 、 、 、 ;写出它们的最高价氧化物的通式: 、 、 、 ;写出它们的最高价氧化物的水化物通式: 、 、 、 。以R代表第ⅠA、ⅡA、ⅢA族的金属元素,写出它们的最高价氧化物的通式: 、 、 ;写出它们的最高价氧化物的水化物通式: 、 、 。
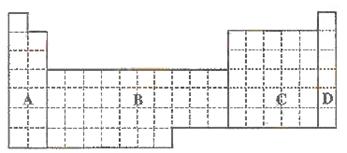
17.在下面元素周期表中画出金属元素与非金属元素的分界线:
18.无机化学命名委员会(国际组织)在1989年作出决定:把周期表原先的主、副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列。按这个规定,下列说法正确的是
A第3列元素种类最多,第14列的化合物种类最多 B.每1列都有非金属元素
C.从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低
D.只有第2列元素的原子最外层有2个电子
19.第119号未知元素,有人称为“类钫”。根据周期表结构及元素性质变化趋势,有关“类钫”的预测的说法错误的是
A、单质有较高的熔点 B、“类钫”在化合物中呈+1价
C、“类钫”具有放射性 D、“类钫”单质与水剧烈反应
20. 下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl D.还原性强弱: F- > Cl- > I-
21.下列微粒半径大小比较正确的是
A.Na < Mg2+ < Al3+ < F- B.S2- < Cl-< Na+ < Al3+
C.Na > Mg > Al > S D.Cs < Rb < K < Na
22.某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素
A.在周期表中处于第三周期ⅦA族 B.在周期表中处于第2周期ⅤA族
C.氢化物比H2O稳定 D.常见化合价只有-3、+2、+3、+5价
23.关于元素周期表, 下列叙述中不正确的是
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在非金属元素区域可以寻找制备新型农药材料的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
24.A 和 B 是同周期的相邻元素, B 和 C 是同主族的相邻元素, 且A、B、C 最外层电子数之和为 19,则A、B、C三种元素按照顺序是
A.N、 F、 Cl B.F、 O 、S C.S、 Cl 、O D.S 、O 、F
25.电子层数相同的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4> H2YO4> H3ZO4。下列判断错误的是
A、原子半径:X>Y>Z B、气态氢化物的稳定性:HX>H2Y>ZH3
C、非金属性:X>Y>Z D、单质氧化性:X>Y>Z
26.A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称___ _____;B在周期表中的位置第 ______周期,第________族;
(2)A、B形成的化合物的电子式____ ____;
(3)C的元素符号________,C的最高价氧化物的化学式____ ____;
(4) D的最高价氧化物对应的水化物的化学式____ ____.
三、化学键
27.下列说法中正确的是
A.在共价化合物中也可能含有离子键 B.非金属之间形成的化学键一定是共价键
C.含有共价键的化合物一定是共价化合物 D.双原子单质分子中的共价健一定是非极性键
E.含有离子键的化合物一定是离子化合物 F.离子键是阴阳离子间的静电吸引
G.所有的化学物质中都有化学键 H.化合物中可能含有非极性键
28.请写出MgCl2、CO2、N2、KOH、Na2O2、CCl4、NH4Cl、HClO的电子式,是共价分子的还要写出结构式。用电子式表示Na2O和CO2的形成过程。
29.(1) A、B两主族元素属于同一周期,它们的原子能以共价键结合成化学式为AB2型分子,A、B元素在周期表中的族序数可能为
A.ⅠA、ⅤA B.ⅠA、ⅦA C.ⅣA、ⅥA D.ⅡA、ⅦA
(2)下列物质中各原子最外层都满足8电子结构的是 。
①H2S②SiF4③NaCl④Na2O2⑤N2⑥BeCl2⑦BCl3⑧NCl3⑨PCl5⑩XeF4
30.下列变化中①NaCl 溶于水 ②HCl 溶于水 ③ O2 溶于水 ④Na2O2溶于水 ⑤ I2升华 ⑥固体NaOH熔化。未发生化学键破坏的是 ,仅发生离子键破坏的是 ,仅发生共价键破坏的是 ,既发生离子键破坏,又发生共价键破坏的是 ( 填序号)
31.下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(1) 在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。原子结构示意图为_____________________ 。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 最高价氧化是两性氧化物的元素是_____ ____;写出它的氧化物与氢氧化钠反应的离子方程式_____ _________ _________ _________ _________ ____。
(4) 用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”下同)键形成的。
32.已知元素的电负性与元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性。
| 元 素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负 性 | 1.5 | 2. | 1.5 | 2.5 | 2.8 | 4. | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
根据以上的数据,可推知元素的电负性具有的变化规律是: 。
参考答案
1.50 2.C 3.B [x+n,A-x-n,m(A-x+n)/A] 4.3:1 5[18,7 ] 5.AD 6.B 7.AD 8.略
9.门捷列夫 相对原子质量 10.7,7,电子层数,1、2、3周期,2、8、8,4、5、6,18、18、32,7周期,26,32 11.18,16,7,7,0,Ⅷ,最外层电子数。12.第四周期ⅦA族,第七周期ⅥA族。 13.略 14.C 15.减小,增强,减弱,增强,增大,减弱,增强,减弱。
 16.最外层电子数,主族序数,价电子数,F,O,最外层电子数-8,RH4、RH3、H2R、HR,RO2、R2O5、RO3、R2O7,H2RO3、HRO3(或H3RO4)、H2RO4、HRO4,R2O、RO、R2O3,ROH、R(OH)2、
16.最外层电子数,主族序数,价电子数,F,O,最外层电子数-8,RH4、RH3、H2R、HR,RO2、R2O5、RO3、R2O7,H2RO3、HRO3(或H3RO4)、H2RO4、HRO4,R2O、RO、R2O3,ROH、R(OH)2、
R(OH)3 17.见右图
18.A 19.A 20.CD 21.C 22.B 23.D 24.B 25.A
26.1)氮;二,第ⅤA族;(2)NH3的电子式略 ;(3)S,SO3。 (4)KOH
27.DEH 28.略 29.(1)C(2)②③④⑤⑧ 30.③ ⑤、①⑥、②、④
31.(1)Ar; (2)HClO4;![]() ;(3)Al;Al2O3+2OH-=2AlO2-+H2O;
;(3)Al;Al2O3+2OH-=2AlO2-+H2O;
(4)![]() ;离子。 (5)
;离子。 (5)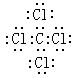 ;极性共价键
;极性共价键
32.在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化