高一化学物质结构元素周期律测试题(A卷)
相对原子质量:H=1 S=32
一、选择题(每小题有1~2个选项符合题意,请把答案填入本大题后表格,每小题4分,共56分)
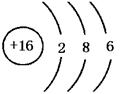
1. 32He可以作为核聚变材料,下列关于32He的叙述正确的是( )
A、32He和互31H同位素 B、32He原子核内中子数为2
C、32He原子核外电子数为2 D、32He代表原子核内有2个质子和3个中子氦原子
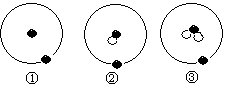 2.简单原子的原子结构可用右下图表示方法形象表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述错误的是( )
2.简单原子的原子结构可用右下图表示方法形象表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述错误的是( )
A.①②③属同种元素
B.①②③互为同位素
C.①②③为碳元素的三种核素
D.①②③是三种化学性质不同的粒子
3.元素的性质呈周期性变化的根本原因是( )
A.元素原子量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化
4.某元素R的最高价氧化物对应水化物化学式为HnRO4,则R的氢化物是
A.HnR B.H2nR C.H(8-n)R D.H(n-2)R
5. 0.05 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
A.第三周期第IA族 B.第三周期第ⅡA族
C.第四周期第IA族 D.第四周期第ⅡA族
6. 今有A、B两种原子,已知A原子的核外电子总数是B原子核外电子总数的1/2倍,B原子的L层电子数为A原子L层电子数的2倍,A和B分别是( )
A、铍原子和氧原子 B、硼原子和氦原子 C、氯原子和碳原子 D、碳原子和镁原子
7.元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )
A.11和16 B.6和8 C.12和17 D.20和9
8、下列化合物中,含有非极性键的离子化合物是( )
A.MgCl2 B.Ba(OH)2 C.Na2O2 D.H2O2
9.下列叙述正确的是
A.非金属原子间以共价键结合的物质都是共价化合物
B.含有共价键的化合物都是共价键化合物
C.凡是能电离出离子的化合物都是离子化合物
D.凡是含有离子键的化合物都是离子化合物
10、下列电子式书写正确的是( )
A. O C O B.Ca2+ [ Cl ]-2
C.[ O H ]- D.
11、下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
 |
| ||||||||||||||
| |||||||||||||||
12、已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子半径:X>Y>W> Z B.原子序数:Y>X>Z>W
C.原子最外层电子数:Y>X>Z>W D.原子的电子层数X=Y>W=Z
13、已知铍元素是第二周期第ⅡA族元素,下列叙述正确的是( )
A.常温下,单质铍能与水反应放出H2
B.Be(OH)2不溶于水
C.Be(OH)2溶于盐酸,也可能溶于NaOH溶液
D.BeCl2中各原子中的最外层电子层都满足8电子结构
14.无机化学命名委员会(国际组织)在1989年作出决定,把长式元素周期表原先的主、副族 及族号取消,由左到右改为18列,如碱金属族为第1列,稀有气体元素为第18列。按此规定 ,下列说法中错误的是( )
A.第16、17列都是非金属元素
B.第2列12列元素全部是金属元素
C.只有第2列元素原子最外层有2个电子
D.在18列元素中,第3列元素种类最多
班级: 姓名: 学号:
一、选择题答题卡:每小题有1~2个选项符合题意,请把答案填入本大题后表格,每小题4分,共56分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
二:非选择题:(44分)
15.(8分)(1)用电子式表示下列化合物的形成过程:
① 硫化氢
② 氟化镁
(2)①某元素(用X表示)的粒子中含有26个质子,28个中子和24个电子,该粒子的化学符号是
② 由同周期元素组成的气态化合物A的结构式为X=Y=X,其中各原子最外层都满足8电子结构,则A的化学式为
16.(7分)右图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数等于B的质量数,B元素的原子核内质子数等于中子数,回答下列问题
|
(2)在这三种元素的氢化物中分别通入氯气,写出能发生反应的化学
方程式:
17.(12分)现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
|
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
回答下列问题:
(1)③的元素符号是 ,⑧的元素名称是 。①在元素周期表中的位置是(周期、族) 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___ ____;名称
是 ;碱性最强的化合物的电子式是:____ _________; 属何类化合物(指离子化合物或共价化合物) 。
(3)比较④和⑦的氢化物的稳定性
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式
。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式 。
18、(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是____________,乙物质的电子式是____________·
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是____________(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是_________ __。
(4)简述比较D与E金属性强弱的实验方法:
。
19、(7分)元素R的气态氢化物化学式HXR,在标况下,8.5g HXR 气体的体积是5.6L,
现将标况下3.36L 气体通入200ml 0.75 mol/L 的CuCl2 溶液中正好完全反应,生成黑色沉淀和HCl。求:① HXR的摩尔质量 ② X值 ③ 写出R的元素名称,画出它的原子结构示意图(①②要写出计算过程)。
第一章《物质结构 元素周期律》测试题(A卷)答案
一、选择题(每小题有1~2个选项符合题意,请把答案填入本大题后表格,每小题4分,共56分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| C | D | C | A | D | D | C D | C | D | C | A D | C | B C | A C |
![]()
15、(8分)(1)①②略 (2)① X ② CO2
16.(7分)(1)N ; F ; S
(2)2NH3 + 3Cl2 = N2 + 6HCl H2S + Cl2 = 2HCl + S↓
17、(12分)(1)Li ;硼;第二周期第ⅥA族
(2)HClO4、高氯酸 Na+[ O H ]- 、离子化合物
(3)NH3 > PH3
(4)NH3 + HNO3 = NH4NO3
(5)Mg(OH)2 + 2H+ = Mg2+ + 2H2O
18、(10分)
(1)第三周期第ⅡA族 ![]() (2)O<N<Al<Mg<Na
(2)O<N<Al<Mg<Na
(3)2Al+2OH--+2H2O=2AlO2--+3H2↑
(4)镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应。(其他答案合理也可以给分)。
19、(7分) ① 34g /mol
② X=2
③ R为硫