一第一章《物质结构 元素周期律》测试题(B卷)
相对原子质量:H=1 Na=23 S=32
一、选择题(每小题有1个选项符合题意,请把答案填入本大题后表格,每小题4分,共56分)
1、以下互为同位素的是( )
A、石墨与金刚石 B、D2和T2
C、CO和CO2
D、![]() 和
和![]()
2.元素的性质呈周期性变化的根本原因是( )
A.元素原子量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化
3、甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.x+16 B.x+4 C.x+8 D.x+18
4.下列电子式书写正确的是
A. O C O B.Ca2+ [ Cl ]-2
![]()
![]()
C.Cl C Cl D.Na+ [ O O ]2- Na+
5、下列各图为元素周期表的一部分,表中的数字为原子序数,其中M的原子序数为37的是( )
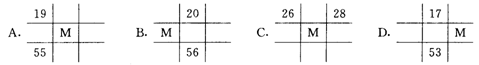
6、下列各组性质比较中,不正确的是( )
A、酸性:HClO4>HBrO4>HIO4 B、碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
C、氧化性:F2<Br2<I2 D、还原性:Li<Na<K
7、下列化合物中,既有离子键,又有共价键的是 ( )
A.CaCl2 B.HNO3 C.CO2 D.KOH
8.![]() -NMR(核磁共振)可用于含碳化合物的结构分析,
-NMR(核磁共振)可用于含碳化合物的结构分析,![]() 表示的含义错误的是
表示的含义错误的是
A.表示碳元素的一种同位素
B.表示碳元素的一种核素
C.质量数是13,原子序数是6,核内有7个质子
D.质量数是13,原子序数是6,核内有7个中子
9、下列粒子中,其最外层与最里层的电子数之和等于次外层电子数的是( )
A. S B.Mg C. Cl D. Be
10、某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX B. H2X C. XH3 D. XH4
11. 锗(Ge)是第四周期第 ⅣA 元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是
A.锗 是一种金属性很强的元素 B.锗的单质具有半导体的性能
C.锗化氢(GeH4)稳定性很强 D.锗酸(H4GeO4)是难溶于水的强酸
12、同周期的X、Y、Z三元素, 其最高价氧化物对应水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4, 则下列判断正确的是( )
A.原子半径 X>Y>Z B.非金属性 X>Y>Z
C.阴离子的还原性按X、Y、Z的顺序由强到弱
D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强
13.下列4组原子序数的元素, 彼此间能形成共价键的是 ( )
A.8和11 B. 9和12 C. 15和8 D. 12和17
| A | ||
| B | C |
14.短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
班级: 姓名: 学号:
一、选择题答题卡:(每小题有1个选项符合题意,请把答案填入本大题后表格,每小题4分,共56分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
二:非选择题:(44分)
15.(4分)用电子式表示下列化合物的形成过程:
(1)硫化氢
(2)氟化镁
16.(18分)下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ;
(4)在B、C、D、E、F、G、H中,原子半径最大的是 .
17、(9分)右图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
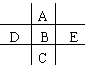 (1) 写出B、D、E最高氧化物对应水化物的化学式:
(1) 写出B、D、E最高氧化物对应水化物的化学式:
_______、_______、_______。其中酸性最强的是
(2)写出A、B、C所形成气态氢化物的化学式: 、
、 。其中最稳定的是 。
(3)D和E组成的一种化合物,化合物中各原子最外层都满足8电子结构,这种化合物的电子式是 。
(4)写E的单质与B的氢化物反应的化学方程式 。
18.(10分)已知A、B、C、D、E都是短周期元素,且原子序数依次增大,其中A和D的原子的最外层电子数都是各自电子层数的2倍;B和C能组成C2B或C2B2型化合物;在C2B中C的阳离子和B的阴离子电子层结构相同;E的质子数是A与C的质子数之和。
(1)写出各元素的名称:A 、B 、C 、
D ,E 。
(2)按下列要求写出化学式:
① 只含有非极性共价键的气态单质是(任写两种) ;
② 只含有极性共价键的气态化合物是(任写两种) ;
③ 既含离子键,又含非极性共价键的化合物是 。
第一章《物质结构 元素周期律》测试题(B卷)答案
一、选择题(每小题有1个选项符合题意,请把答案填入本大题后表格,每小题4分,共56分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| D | C | B | D | B | C | D | C | A | B | B | B | C | C |
15、(4分)(略)
16、(18分)(1)Ne、F、F2、Na (2)NaOH、HClO4、Al(OH)3 (3)HF (4)Na
17、(12分)(1)H2SO4 H3PO4 HClO4 ; HClO4 (2)H2O H2S H2Se ;H2O
(3)(略) (4)H2S + Cl2 = 2HCl + S↓
18、(10分)(1)A 碳 B 氧 C 钠 D 硫 E 氯
(2)① O2、Cl2 ② CO2、SO2 ③ Na2O2
