高一化学必修2《化学与自然资源的开发利用》单元测试题(A卷)
可能用到的原子量:
H = 1 C = 12 N = 14 O = 16 Na = 23 Al = 27
S =32 Cl = 35.5 K = 39 Ca = 40 Fe = 56 Zn = 65
一、选择题:( 本题有14个小题,每小题有1~2选项符合题意,每小题4分,共56分。)
1.2008年夏季奥运会将在北京举行,届时要突出“绿色奥运、人文奥运、科技奥运”理念。绿色奥运是指
A.加大反恐力度,并讲求各国运动员的营养搭配,使他们全身心投入比赛。
B.严禁使用兴奋剂,使运动员公平竞争。
C.把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
2.目前,工业上冶炼铝通常采用的方法是
A.CO或氢气还原法 B.铝热反应法
C.电解法 D.热分解法
3.下列化工生产过程中所发生的反应不属于氧化还原反应的是
A.用大理石制生石灰
B.用铝土矿制金属铝
C.用氯气和消石灰制漂白粉
D.用氢气和氮气合成氨
4.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学,原子经济性要求的是
A.乙烯聚合为聚乙烯高分子材料 B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜 D.用乙烯水化得乙醇
5.随着世界人口的急剧增长、工业的蓬勃发展,淡水供应危机日益成为世界关注的焦点,海水约占地球现有总水量的97%,海水淡化问题已成为科学家的主要研究方向,若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是
A.加入明矾,使海水的盐份沉淀并淡化
B.利用太阳能,将海水蒸馏淡化
C.将海水通过离子交换树脂,以除去所含的盐分
D.利用半透膜,采用反渗透法而使海水淡化
6.人们把食品分为绿色食品、蓝色食品、白色食品等.绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的叫蓝色食品,通过微生物发酵制得的食品叫白色食品.下面属于白色食品的是
A.酱油 B.面粉 C.海带 D.菜油
7.下列说法正确的是
A.所有不锈钢都只含有金属元素
B.大多数金属元素均以单质形式存在于自然界
C.广东正在打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
8.污水处理的主要方法有:①中和法 ②化学沉淀法 ③氧化还原法 ④过滤法
其中属于化学变化的是
A.①②③ B.①②④ C.②③④ D.①②③④
9.从海水中可获得的在常温下为液体的单质是
A.Mg B.K C.Br2 D.I2
10.下列有关煤、石油、天然气等资源的说法正确的是
A.石油裂解得到的汽油是混合物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化石燃料
D.煤就是碳,属于单质
11.近年来,在我国部分海域中出现了大面积的“赤潮”,给当地渔业造成了重大损失,赤潮直接威胁着人类生存的环境,已经成为我国目前最主要的海洋灾害之一。下列关于赤潮发生原因的叙述正确的是
A.含氯化合物直接排入大海,引发赤潮的发生
B.赤潮发生的根本原因是含氟制冷剂大量使用导致臭氧层破坏的结果
C.含氮、磷的大量污水直接排入大海,导致某些浮游生物爆发性繁殖是赤潮发生的直接原因
D.空气中二氧化碳浓度升高,导致海洋温度升高,引发了赤潮的发生
12.近年来,广州市的大部分公交车及部分出租车已采用LPG(液化石油气)作为汽车的燃料,其主要目的在于
A.防止石油短缺 B.降低成本
C.减少对大气的污染 D.加大发动机的动力
13.在冶金工业上,均不能用通常化学还原剂制得的金属组是
A.Na、Mg 、Al B.Na、K 、Zn
C.Fe、Cu、Ag D.Na、Ca、K
14. 第28届国际地质大会提供的资料显示,在海底蕴藏着大量的天然气水合物,俗称“可燃冰”。其蕴藏量是地球上煤和石油的几百倍,因而是一种等待开发的巨大能源物质。有关可燃冰的下列预测中错误的是
A.高压、低温有助于可燃冰的形成 B.可燃冰的主要成分是甲烷
C.可燃冰的微粒间可能存在着离子键 D.构成可燃冰的原子间存在着极性共价键
二.非选择题(共5小题,共44分)
15.(10分)铁是地壳中含量很丰富的元素,也是生物体所必需的元素。金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参与反应的两个化学方程式:_____________________________ ____________________________________________________________________________。
(2)写出赤铁矿被CO还原成铁的化学方程式:_______________________________________。
(3)某高炉每天生产含铁96%的生铁70t,计算需用含20%杂质的赤铁矿 吨。
16.(10分)用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
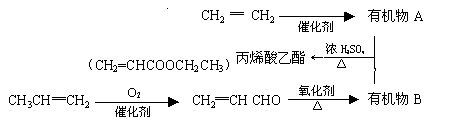 |
根据以上材料和你所学的化学知识回答下列问题:
(1)由CH2=CH2制得有机物A的化学反应类型是 ;
(2)丙烯醛[ CH2═CH CHO ]中含有的官能团 (填名称);
(3)A与B合成丙烯酸乙酯的化学反应方程式是:
________________________________________________________________________;
该反应的类型是 反应 。
(4)由石油裂解产物乙烯合成聚乙烯塑料的化学方程式是:
。
17.(12分)碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
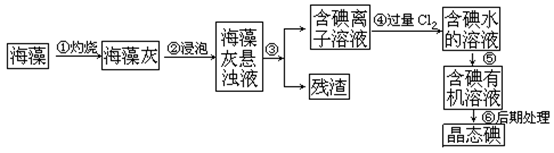
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③_______________,
步骤⑤_______________。
(2)写出步骤④对应反应的离子方程式:______________________________。
(3)提取碘的过程中,可供选择的有机试剂是_______________。
A. 酒精 B. 醋酸 C. 四氯化碳 D. 苯
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是_________________________________________________________。
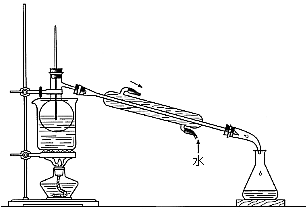
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。
18.(6分)煤是宝贵的化石燃料,但将煤直接作燃料太浪费!可以通过煤的___________获得焦炭、煤焦油和出炉煤气等产品。 煤的气化是指将煤在高温下与水接触转变为可作为工业或民用燃料以及化工合成原料的煤气,请写出煤的气化的化学反应方程式:
____________________________________________________________________________。
煤的液化是指把煤转化成液体燃料的过程。如在一定条件下,使煤与
作用生成液态燃料。
19.(6分)取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为 。
引发铝热反应的实验操作是 。
做铝热反应时,内层纸漏斗底部剪一小孔用水润湿的目的是
。
[参考答案与评分标准]
一、选择题(每小题4分,共56分)
1.C 2.C 3.A 4.AD 5.A 6.A 7.D 8.A 9.C
10.AC 11.C 12.C 13.AD 14.C
二. (共44分)
15.(10分)C+O2 ![]() CO2 (2分),
C+CO2
CO2 (2分),
C+CO2 ![]() 2CO (2分);
2CO (2分);
3CO+Fe2O3 ![]() 2Fe+3CO2 (2分),
2Fe+3CO2 (2分),
120(分)
![]() 16.(10分)(1)(2分)加成反应; (2)(2分)碳碳双键、醛基;
16.(10分)(1)(2分)加成反应; (2)(2分)碳碳双键、醛基;
(3)(2分)CH2=CHCOOH+CH3CH2OH CH2=CHCOOCH2CH3+H2O
![]()
|
(4)(2分)nCH2=CH2 —CH2—CH2—
17.(12分)(1)过滤 (2分),萃取 (2分)
(2) Cl2 +2I- === I2 +2Cl- (2分)
(3)CD (2分) (4)分液漏斗 普通漏斗 (2分)
(5)温度计水银球的位置不对 (2分)
18.(6分) 干馏 (2分)
|
C(s) + H2O(g) → CO(g) + H2(g) (2分)
氢气 (2分)
19. (6分) Fe2O3+2Al ![]() 2Fe+Al2O3 (2分)
2Fe+Al2O3 (2分)
加少量KClO3 , 插上镁条并将其点燃 (2分)
使熔融物易于落下且防止纸漏斗着火 (2分)