高一化学第二学期期中考试试题
考试时间:90分钟 试卷分值:100分
注意:本试卷包含Ⅰ、Ⅱ两卷。第Ⅰ卷为选择题,所有答案必须用2B铅笔涂在答题卡中相应的位置。第Ⅱ卷为非选择题,所有答案必须填在答题卷的相应位置。答案写在试卷上均无效,不予记分。
第Ⅰ卷(选择题 共66分)
可能用到的相对原子质量:H-
一、选择题(每题3分,共66分。每小题只有1个选项符合题意。所有答案必须用2B铅笔填涂在答题卡中相应位置,否则该大题不予计分。)
1.19世纪末,人类开始揭开原子内部结构的秘密,最先发现电子的科学家是:
A.法国科学家拉瓦锡 B.意大利科学家阿伏加德罗
C.英国科学家汤姆逊 D.英国科学家道尔顿
2.
A、
C、15N 与14N 互为同位素 D、15N的核外电子数与中子数相同
3.根据元素的原子序数,可推知原子的是:
①质子数②中子数③质量数④核电荷数⑤核外电子数
A.①②③ B.①④⑤ C.②③④ D.③①⑤
4.下列各组为两种元素的原子序数,其中不能反应生成AB3型化合物的是:
A.13和17 B.16和
5.对第n电子层,若它作为原子的最外层,则容纳的电子数最多与(n-1)层的相同;当它作为次外层,则其容纳的电子数比(n+1)层上电子数最多能多10个,那么第n层为:
A.L层 B.M层 C.N层 D.任意层
6.47Ag有两种同位素,在自然界所占的原子百分比几乎相同,若Ag的近似相对原子质量为108,则这两种同位素的中子数为:
A.106和110 B.57和
7.已知下列元素的半径为:
| 原子 | N | S | O | Si |
| 半径r/10- | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是:
A.1.10×10-
8.下列事实,不能说明氯元素的非金属性比硫元素强的是:
A.氯气与H2S能发生置换反应 B.HClO4酸性比H2SO4强
C.盐酸是强酸,氢硫酸是弱酸 D.受热时,氯化氢比硫化氢稳定
9.某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数:
A.只有x+1 B.可能是x+8
C.可能是x+2 D.可能是x+1或x+11或x+25
10.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是:
A.半导体材料砷化镓 B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌 D.超导材料K
11.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是:
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
12.已知反应KClO3+ 6HCl = KCl + 3Cl2↑+ 3H2O,若用K35ClO3与H37Cl作用,下列说法中正确的是:
A.生成的Cl2相对分子质量约为73.3 B.该反应转移电子数为6
C.KCl中只含有35Cl D.KCl中同时含有35Cl和37Cl
13.下列原子中,最容易形成阳离子的是
![]()
14.下列各组中每种物质都既有离子键又有共价键的一组是:
A.NaOH H2SO4 (NH4)2SO4 B.MgO Na2SO4 HNO3
C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
15.反应C(s)+H2O(g)![]() CO2(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:
CO2(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:
A.增加C的量 B.将容器的体积缩小一半
C.保持体积不变,升高温度 D.压强不变充入N2使容器体积增大
16.下列说法中,可以证明反应N2+3H2![]() 2NH3已达到平衡状态的是:
2NH3已达到平衡状态的是:
A.1个N≡N键断裂的同时,有6个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
17.已知氟化氢气体存在下列平衡:2H![]() 3H
3H![]() 2HF
2HF
若平衡时混合气体的平均摩尔质量为
A.小于10% B.大于10% C.等于10% D.大于或等于10%
18.在恒温、恒容条件下,反应![]() C(g)+3D(g)从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1;则以下叙述正确的是:
C(g)+3D(g)从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1;则以下叙述正确的是:
A.两途径最终达到平衡时,体系内混合气的百分组成相同
B.两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,途径Ⅰ的反应速率v1(A)等于途径Ⅱ的反应速率v2(A)
D.达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的2倍
19.现有一定条件下进行的反应:Cu+2H2O=Cu(OH)2+H2↑,有人想根据该反应设计原电池,下列说法正确的是:
A.可以铜为负极,碳为正极,氯化钠为电解质溶液构成原电池
B.可以铜为正极,碳为负极,氯化钠为电解质溶液构成原电池
C.可以铜为负极,碳为正极,稀硫酸为电解质构成原电池
D.该反应不能构成原电池
20.电子表电源常用微型银—锌电池,电极分别是Ag2O和Zn,电解液为KOH溶液,电极反应为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO,根据上述变化下列判断正确的是:
A.Zn是负极,Ag2O是正极
B.Zn是正极,Ag2O是负极
C.工作时电子由Ag2O极经外电路流向Zn极
D.工作时,电池负极区溶液OH-浓度增大
21.如下图各装置中均盛有海水,铁在其中被腐蚀由快到慢的顺序正确的是:
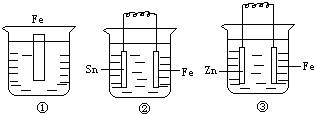
A.①>②>③ B.②>①>③
C.③>②>① D.②>③>①
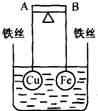 22.如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化):
22.如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化):
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
第II卷(非选择题 共34分)
二.填空题(每空2分,共28分)
23.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是 ,可用于制半导体材料的元素是_______。
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ;(填写最高价氧化物的水化物的化学式)
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 。
24.下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ)。这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
回答下列问题:
(1)在HCl、HBr、HI中,最稳定的是__________;
(2)对于反应X2 + H2=2HX(X2代表Cl2、Br2、I2),相同条件下,消耗等量氢气时,放出热量最多的是__________;
(3)反应Br2 + H2=2HBr,当生成2 mol HBr时放出_________ kJ能量。
25.在一个容积固定为
(1)将1 mol N2O4放入此容器,N2O4发生如下分解反应:
N2O4(g)![]() 2NO2(g)(正反应吸热)
2NO2(g)(正反应吸热)
平衡时,测得混合气体(N2O4和NO2)的压强为同温下N2O4(g)尚未分解时压强的1.2倍,此时N2O4的体积分数为Φ。
平衡时容器内NO2和N2O4的物质的量之比为______________;升高温度,N2O4的分解率______________(增大或减小);
(2) 恒温时,向此容器内加入1 mol NO2,发生如下反应:2NO2(g)![]() N2O4(g)。达到平衡时,其它条件不变,若向容器中分别增加①1
mol NO2或②1 mol N2O4,重新达到平衡后,与第一次平衡时相比,NO2的体积分数______________。
N2O4(g)。达到平衡时,其它条件不变,若向容器中分别增加①1
mol NO2或②1 mol N2O4,重新达到平衡后,与第一次平衡时相比,NO2的体积分数______________。
A. ①②都增大 B. ①②都减小 C. ①增大,②减小 D. ②增大,①减小
(3) 恒温时,向此容器内加入x mol NO2 和y mol N2O4(y≥0),若要使平衡后N2O4的体积分数仍为Φ,且反应朝着逆反应方向进行,则x的取值范围是___________________。
26.燃料电池具有高的发电效率,因而受到重视。
(1)可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在
 负极反应式:2CO+2CO32--4e-=4CO2
负极反应式:2CO+2CO32--4e-=4CO2
正极反应式:________________________;
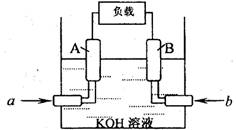
(2)某甲烷一氧气燃料电池的结构如图所示,该电池的两个电极均由多孔碳制成,以KOH溶液为电解质溶液,气体由多孔碳隙逸出并在电极表面放电,反应后溶液中K2CO3增多。写出该电池的负极反应式: ________________________;
三.计算题(6分)
27.由Cu片,Zn片和300mL稀H2SO4组成的原电池中,若锌片发生腐蚀,则当铜片上共放出
(1)有 个电子通过了导线。
(2)产生这些气体消耗锌多少克,原稀H2SO4的物质的量浓度为多少?

![]() 高一化学答题卷
高一化学答题卷
| 题号 | 一 | 二 | 三 | 总分 |
| 得分 |
二.填空题(每空2分,共28分)
23.(1) __________,__________。
(2) _____________, _____________(填写最高价氧化物的水化物的化学式);
(3) _____________。
24.(1)____________;(2)__________;(3)_________ kJ。
25.(1) ______________; ______________(增大或减小);
(2) ______________; (3) ___________________。
26.(1) _________________________________________________;
(2) _________________________________________________。
三.计算题(6分)
27.(1)有__________________________个电子通过了导线。
(2)
高一化学参考答案
一、选择题(每题3分,共66分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | C | B | C | B | D | A | C | D | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | A | C | C | A | C | B | A | D | A |
| 21 | 22 | ||||||||
| B | D |
二.填空题(每空2分,共28分)
23.(1)Ar、Si (2)NaOH、HClO4 (3)HF
24.(1)HCl (2) Cl2 (3) 103
25.(1)1∶2, 增大 (2) B (3) 0.4<x≤2
26.(1)O2+2CO2+4e-=2 CO32-;(2)CH4 + 10OH--8e-=CO32-+ 7H2O
三.计算题
27.1.806×1023、