高一化学第二学期第一次质量检测试题卷
(2008年3月)
考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.所有答案必须写在答题卷上,写在试卷上无效。
3.考试结束,只需上交答题卷。
可能用到的相对原子质量:
H—1 C—12 S—32 O—16 Na—23 Cl—35.5 Cu—64 N—14 K—39 Mn --55
一.选择题(本大题共20小题,每小题只有一个选项符合题意,每小题2分,共40分)
1.![]() 、
、![]() 、
、![]() 、H+、H2是
、H+、H2是
A.氢元素的五种不同粒子 B.五种氢元素
C.氢的五种同素异形体 D.氢的五种同位素
2.下列电子式正确的是
![]()
3.现代城市空气污染物之一NO主要来源于汽车尾气,汽车尾气中产生NO的原因是
A.汽车燃料油(如汽油、柴油)中含氮,NO是其燃烧产物
B.是空气中的N2和汽车燃料油发生了化学反应
C.空气中的N2与O2在汽车汽缸内的高温环境下发生反应的产物
D.是汽车排出的高温尾气导致空气中的N2和O2发生化合反应
4.不能用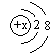 来表示其结构的微粒是
来表示其结构的微粒是
A.Ne B.F - C.Al3+ D.S 2 -
5.某粒子用符号![]() M
M![]() 表示,下列关于该粒子的叙述中,正确的是
表示,下列关于该粒子的叙述中,正确的是
A.所含质子数为(A-n) B.中子数—电子数=A-2Z+n
C.所含电子数为(Z+n) D.所含中子数为(A-Z-n)
6.不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量较低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
7.以下元素的原子半径大小关系不正确的是(X表示原子,其左下标为相应的核电荷数)
A.4X > 5X B. 9X > 11X C. 3X > 1X D. 15X > 17X
8.以下对元素的性质判断正确的是
A.元素的最高价氧化物的水化物碱性越强,该元素的金属性就越强
B.元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强
C.元素的单质和水的反应越剧烈,该元素的非金属性就越强
D.元素的单质越容易和氢气化合,该元素的金属性就越强
9.某主族元素R的原子其电子式可用下式表示:![]() 。该元素组成的以下物质,其分子式肯定错误的是
。该元素组成的以下物质,其分子式肯定错误的是
A.最高价氧化物分子式为R2O5 B.含氧酸分子式为 HRO3
C.含氧酸分子式为H3RO4 D.气态氢化物分子式为RH5
10.以下关于元素周期表的结构叙述正确的是
A.元素周期表有七个主族,八个副族
B.元素周期表有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.零族位于元素周期表的第18列(从左往右)
D.第三主族位于元素周期表的第三列(从左往右)
11.下表中四种物质的结构式或球棍模型有错误的是
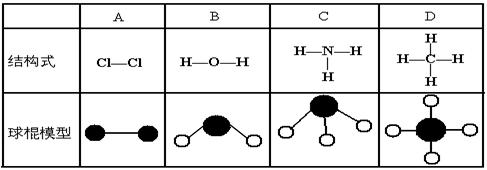
12.下列各微粒中, 核外电子总数相等的是
A.Na和Na+ B.N2 和 CO2 C.NH4+ 和 H3O+ D.H2S 和 H2O
13.A、B、C、D是同周期元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中半径最大的,则它们的原子序数由小到大的顺序是
A.E、B、A、D、C B.D、B、C、A、E
C.E、C、D、B、A D.A、B、C、D、E
14.下列各表中的数字代表的是元素的原子序数。表中数字所对应的元素与它们在周期表中的位置相符的是

15.共价键、离子键和分子间作用力是构成物质微粒间的不同的作用方式,下列物质中只含有上述一种作用的是
A.氯化钠 B.干冰 C..氢氧化钠 D.碘
16.最近医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关14C的叙述正确的是
A.与C60中普通碳原子的化学性质不同 B.与14N含的中子数相同
C.与12C互为同位素 D.是C60的同素异形体
17.下列物质属于分子晶体的是
A.熔点是1070℃,易溶于水,水溶液能导电
B.熔点是10.31℃,液态不导电,水溶液能导电
C.硬度大,熔点是1112.8℃,沸点是2444.6℃
D.熔点是97.80℃,质软、导电,密度是0.97g/cm3
18.下列各组中,含的离子晶体、分子晶体、原子晶体各一种的是
A.![]() B.金刚石、
B.金刚石、![]()
C.HF、 SiO2 、 Ar
D.![]()
19. 将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用①共价键 ②离子键 ③分子间作用力,正确的顺序是
A.①②②③ B.②①②③ C.②③②① D.①①②③
20. A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn—、Cm—具有相同的电子层结构,且n > m ,则下列关系正确的是
A.a > b > c B. a > c > b C.a = b + m + n D.a = c – n - m
二.非选择题(本大题共8小题,共50分)
21. 下列变化中①NaCl 溶于水 ②HCl 溶于水 ③ O2 溶于水 ④SiO2熔化⑤ I2升华。未发生化学键破坏的是 ,仅发生离子键破坏的是 ,仅发生共价键破坏的是 .( 填序号)
22. 元素最高正化合价为+6,其负化合价为________。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为____________。(用R表示)
23.按要求回答下列问题:
(1) 书写电子式NH3:___________________;NaOH:____________________。
(2) 电子层结构与氩原子相同的且带两个单位负电荷的离子的结构示意图_________.
(3) M层电子数与K层电子数相等的原子的元素符号____________.
24. A、B、C、D四种元素均为短周期元素,其原子半径依次减小,它们的气态氢化物分子所含的电子数相同,C元素原子的K层电子数与M层电子数之和等于L层电子数。根据以上信息,按要求写出以下化学式(用A、B、C、D所代表的真实元素符号表示)。
(1)A的最高价氧化物 ; (2)B的气态氢化物 ;
(3)C的最高价氧化物的对应水化物 ;(4)D的单质 。
25. 下面是元素周期表的一部分,针对①—⑩元素填写下列空白
| 主族 周期 | IA |
| O | |||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA |
|
| 2 |
|
|
| ② |
| ③ |
|
|
| 3 | ④ |
| ⑤ |
|
| ⑥ | ⑦ | ⑧ |
| 4 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)⑦元素跟⑩元素两者核电荷数之差是 。
(2)画出⑦元素原子结构示意图______________________________
(3)写出①和⑩形成的化合物的电子式_______________________
(4) ④元素跟⑩元素形成的化合物的化学式是 ,高温下灼烧该化合物时,火焰呈 色。
(5) ④和⑤最高价氧化物对应的水化物相互反应的化学方程式为_____________________
(6) ②和⑦形成化合物的化学式 _______,单质⑩溶于该化学物所得溶液呈_______色。
(7)这些元素的最高价氧化物的对应水化物中________酸性最强;________碱性最强;能形成两性氢氧化物的元素是________。(填化学式)
(8)从④到⑦的元素中,________原子半径最小。(填元素符号)
(9)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
26.有 A、B、C三种短周期元素。A+只含有一个质子没有中子;B的正、负化合价绝对值相等,在同族元素中其氢化物最稳定;C的原子核内质子数是B的最外层电子数的3.5倍。试推断这三种元素分别是:A__ __,B__ __,C 。(用元素符号表示)
27.A元素原子M电子层上有7个电子,B元素与A元素位于同一周期,B元素的原子最外电子层只有1个电子。
(1)画出B元素的原子结构示意图
(2)A、B两元素形成化合物的电子式是: 。
(3)B与水反应的离子方程式_________________________________
28.A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)A元素的名称___ _____;B在周期表中的位置第 ______周期,第________族;
(2) D2C的电子式____ ____;
(3)C的元素符号________,C的最高价氧化物的化学式____ ____;
(4) D的最高价氧化物对应的水化物的化学式____ ___
三.计算题(本大题共2小题,共10分)
29. 短周期主族元素R的族序数是其周期序数的2倍,R在其氢化物中的质量分数为750/0。已知R原子核内的质子数与中子数相等。试通过计算:
⑴确定R是什么元素?
⑵确定R元素在周期表中的位置:
30.实验室可用氯酸钾与浓盐酸反应制取氯气,该反应的化学方程式为: KClO3+6HCl(浓)====KCl+3H2O+3Cl2↑。现将24.5g KClO3跟150mL 12mol/L(过量)盐酸充分反应,求:
⑴生成Cl2的在标准状况下体积为多少升?
⑵将反应后混合液稀释至500mL,此时溶液中Cl-的物质的量浓度为多少?
(KClO3摩尔质量为122.5g/mol)