高一化学(必修2)期中考试试题
说明:1、考试时间90分钟 2、试卷分为第Ⅰ卷、第Ⅱ卷
试卷第一卷69分、第二卷51分,总分满分为120分。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 S∶32
Cl∶35.5 Na∶23 Fe∶56 Zn∶65
第Ⅰ卷
一、选择题(本小题包括23小题,每小题3分,共69分。每小题只有一个选项符合题意,并将选择题的正确选项填入第Ⅱ卷选择题的答题卡中。)
1.截至1999年,人们已经发现了113种
A.原子 B.分子 C.核素 D.元素
2.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”的说法不正确的是
A.该粒子不显电性 B.该粒子的质量数为4
C.该元素在元素周期表中与氢元素占同一位置 D.该粒子的质量比氢原子大
3.下列反应属于吸热反应的是
A.铝与稀硫酸的反应 B.Ba(OH)2.8H2O与NH4Cl的反应
C.甲烷在O2中的燃烧反应 D.盐酸与氢氧化钠的反应
4.含有非极性键的共价化合物是
A.CO2 B.H2O2 C.Na2O2 D.F2
5.下列关于反应限度的叙述不正确的是
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.不少反应都具有可逆性,只是有的程度小,有得程度大
6.在下图的装置中,属于原电池的是
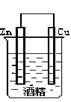
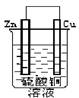
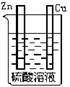
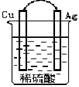
A B C D
7.下列各组微粒具有相同质子数和电子数的是
A.OH-和NH4+ B.H2O和NH3 C.F和OH- D.O2-和NH4+
8.键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。化学反应就是旧键的断裂和新键形成的过程。现查得:H-H、Cl-Cl和H-Cl得键能分别为436KJ/mol、243KJ/mol和431KJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应
A.放热183KJ B.放热91.5KJ C.吸热183KJ D.吸热91.5KJ
9.已知A、B、C、D、E是元素周期表中同一周期的五种元素,A和B的最高价氧化物对应水化物程碱性,且碱性B>A,C和D的气态氢化物水溶液程酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由小到大的顺序是
A.CDEAB B.ECDAB C.BAEDC D.BADCE
10.人造地球卫星用的一种高能电池——银锌电池,器电池的电极反应式为:
Zn+2OH- -2e- = ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,据此判断氧化银是
A.负极,并被氧化 B.正极,并被还原 C.负极,并被还原 D.正极,并被氧化
11.已知2SO2+O2
![]() 2SO3为放热反应,对该反应的下列说法中正确的是
2SO3为放热反应,对该反应的下列说法中正确的是
A.O2的能量一定高于SO2的能量 B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量 D.因该反应为放热反应,故不必加热就可发生
12.过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.升高温度 B.加入少量CuSO4溶液 C.加入适量的水 D.加入浓盐酸
13.下列各组顺序的排列不正确的是
A.酸性强弱: H2SiO3<H2CO3<H2SO4<HClO4 B.碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
C.离子半径:Na+>Mg2+>Al3+>F- D.热稳定性:HF>HCl>H2S>PH3
14.下列关于燃料充分燃烧的说法,不正确的是
A.空气量越多越好 B.应通入适量空气
C.固体燃料燃烧前要粉碎 D.液体燃料燃烧时可以以雾状喷出
15.A+、B2+、C-、D2-四种离子具有相同的电子层结构。现有以下排列顺序:
①B2+>A+>C->D2-;②C->D2->A+>B2+;③B2+>A+>D2->C-;④D2->C->A+>B2+,
四种离子的半径由大到小以及四种元素的原子序数由大到小的顺序分别是
A.②③ B.③② C.①④ D.④①
16.已知反应: A+3B ![]() 2C+D 在某段时间内,以A的浓度变化表示的化学反应速度为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
2C+D 在某段时间内,以A的浓度变化表示的化学反应速度为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5mol·L-1·min-1 B.1 mol·L-1·min-1 C.2 mol·L-1·min-1 D.3 mol·L-1·min-1
17.元素X的原子核外M电子层有3个电子,元素Y2-离子核外共有18个电子,则这两种
元素可形成的化合物为
A.XY2 B.X2Y3 C.X2Y D.X3Y2
18.在核电荷数为1~20的元素中,最外层电子数和电子层数相等的元素共有
A.3种 B.4种 C.5种 D.6种
19.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
A.0.2mol.L-1.min-1 B.0.3mol.L-1.min-1 C.0.4mol.L-1.min-1 D.0.6mol.L-1.min-1
20.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。 某种锂电池的总反应式是Li+MnO2 = LiMnO2。下列说法正确的是
A. Li是负极,电极反应为Li-e-=Li+ B. MnO2是负极,电极反应为MnO2+e-=MnO2-
C. Li是正极,电极反应为Li+e-=Li- D. 锂电池是一种对环境有严重污染的原电池
21.根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
A. X > Z > Y > W B. Z > W > X > Y C. Z > Y > X > W D. Z > X > Y > W
22.在一定温度下,可逆反应A(气)+3B(气)![]() 2C若达到平衡的标志是
2C若达到平衡的标志是
A.C的生成速率与B的生成速率相等 B.A、B、C的浓度不再发生变化
C.A、B、C的分子数之比为1∶3∶2 D.单位时间内生成A n mol,同时生成B 3n mol
23.反应4A(g)+5B(g) ![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是
A.A的平均反应速率是0.010 mol·L-1·s-1 B.容器中含D物质的量至少为0.45 mol
C.容器中A的物质的量一定增加了0.30 mol
D.容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | ||||||||||||
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 |
选择题答题栏
第Ⅱ卷
二、非选择题(40分)
24.(6分)H2O2、KCl、Na2SO4、Na2O2、HCl、O2中只含离子键的是 ,只含极性键的是 ,只含非极性键的是 ,既含离子键又含极性键的是
,既含离子键又含非极性键的是 ,既有极性键又有非极性键的是 。
|
(1) 是正极,
正极的电极反应式: ;
(2) 是负极,
负极的电极反应式: 。
26.(6分)A,B,C,D,E五种元素,它们的原子序数依次增大,A原子最外层有4个电子。B的阴离子与C的阳离子跟氟离子的电子层结构相同。E原子的M层上的电子数比次外层少1个电子。常温、常压下B单质是气体,0.1mol单质B与氢气完全反应时,有2.408×1023个电子发生转移。C的单质在高温下与B的单质充分反应之后,生成淡黄色固体F,F与AB2反应后可生成单质B。D的氢化物化学式是H2D,D的最高氧化物中含有40%的D,而且D原子是由相同数目的质子、中子、电子组成,根据以上的已知条件进行推测:
(1)下列元素的名称:D ,E 。
(2)写出下列的化学方程式:
B+C→F: ;
F与AB2反应: 。
![]()
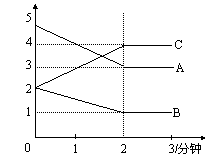 27.(6分)某可逆反应从0—2分钟进行过程中,在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是
,生成物是 ,化学方程式为
27.(6分)某可逆反应从0—2分钟进行过程中,在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是
,生成物是 ,化学方程式为
;反应开始至2分钟时,能否用
C表示反应速率?若能,其反应速率为 ,
若不能,则其原因为_ ________________ ;
2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态。
28.(6分)A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都 有10个电子,其结构特点如下表:
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1— | 0 | 2+ | 1+ | 0 |
其中,B的离子半径大于E的离子半径;D是由极性键构成的4原子极性分子;C常用作F的检验(加热)。请填写下列空白:
(1) A粒子的结构示意图 。
(2) 比较BC和EC2的碱性强弱BC EC2(填< 、> 、= )。
(3) F与C反应的离子方程式 。
29.(10分)分析下列实例,根据已有的知识和经验,填写下表。
| 实 例 | 影响速率的因素 | 如何影响 |
| 夏天食物易变质 | ||
| 硫在氧气中比在空气中燃烧快 | ||
| 粉状的碳酸钙与盐酸反应 比块状的碳酸钙反应快 | ||
| 氯酸钾与二氧化锰混合共热可快速产生氧气 | ||
| 工业合成氨通常要在高压下进行 |
三.计算题(11分)
30.(5分)某元素X的碳酸氢盐 [X(HCO3)2] 在高温下完全分解的产物都是氧化物,现取3.24g这种碳酸氢盐高温完全分解后得到1.12g固体,又知X的原子核里有20个中子。
(1)通过计算确定X是什么元素,并写出它在元素周期表中的位置;
(2)写出X的单质与反应的化学方程式,已知该元素的金属性比钠强,但其单质与水反应没有钠那样剧烈,试分析其原因。
31.(6分)恒温下,将a mol N2与b mol H2的混合气
体通入一个固定容积的密闭容器中,发生如下反
![]() 应:N2 (g) + 3 H2(g) 2NH3(g)
应:N2 (g) + 3 H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。
计算平移时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,![]() (N2)∶
(N2)∶![]() (H2)= 。
(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
参考答案
一、选择题(69分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | D | C | B | B | A | D | B | A | C | B | B | C |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | C | A | D | C | B | A | A | A | D | B | B |
二、非选择题(40分)
24.(6分)KCl; HCl; O2; Na2SO4; Na2O2; H2O2
25.(装置图1分,两极材料和电解液正确1分)
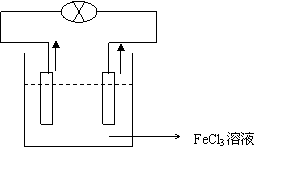


Cu是正极,正极反应式:2Fe3++ 2e–= 2 Fe2+
Fe是负极,负极反应式:Fe ―2e–= Fe2+
e– I
Fe Cu
26.(1)硫;氯; (2)2Na +O2 ==== Na2O2 (3)2Na2O2 + 2CO2 == 2Na2CO3 + O2
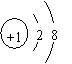 27.(略)
27.(略)
28.(1) (2)> (3)NH4+ +OH― =NH3.H2O
29.
| 实 例 | 影响速率的因素 | 如何影响 |
| 夏天食物易变质 | 温度 | 升高温度,反应速率增大 |
| 硫在氧气中比在空气中燃烧快 | 浓度 | 增大反应物浓度,反应速率增大 |
| 粉状的碳酸钙与盐酸反应 比块状的碳酸钙反应快 | 固体的比表面积 | 增大固体的比表面积,反应速率增大 |
| 氯酸钾与二氧化锰混合共热可快速产生氧气 | 催化剂 | 使用催化剂,反应速率增大 |
| 工业合成氨通常要在高压下进行 | 压强 | 增大气体物质的压强,反应速率增大 |
三.计算题(11分)
30.(共4分)(1)钙,第4周期第ⅡA族(2分)
(2)Ca + 2H2O = Ca(OH)2 + H2↑,因为反应生的Ca(OH)2微溶于水,阻碍了钙与水的反应,故较缓慢(3分)
31.![]() (共6分)⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x = 3 a = 13 + 3 = 16
(共6分)⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x = 3 a = 13 + 3 = 16
解法二:N2 + 3H2 2NH3
开始时 a b 0
t时13
6
在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16
⑵n平(NH3) = 716.8L -1
×25% = 32mol×25% = 8mol
⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2