高一年级化学1月最后综合检测试题
化 学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。考试时间90分钟,总分100分。
第Ⅰ卷(选择题 共60分)
一、选择题(每小题3分,共60分)
1.“绿色化学”的一个含义是指设计没有或只有尽可能小的环境负作用的化学过程。据此,你认为最理想的燃料是 ( )
(A)煤 (B)天燃气 (C)石油 (D)氢气
2.将0.1mol Na投入足量水中,水共获得的电子个数为 ( )
(A)NA/2 (B)2.3NA (C)0.1NA (D)NA
3.下列说法中正确的是 ( )
(A)1 mol/L的NaCl溶液是指此溶液中含有1 mol NaC1
(B)从1 L 0.5mol/L的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.1 mol/L
(C)0℃,1mol Cl2的体积约为22.4 L
(D)1 mol/L的CaCl2溶液中,Cl-的物质的量浓度为2mol/L
4.关于a g氢气和b氦气的下列说法中正确的是 ( )
(A)同温、同压下,氢气与氦气的体积比为a:2b
(B)同温、同压下,若a=b,则氢气和氦气的物质的量之比为2∶1
(C)体积相同时,氢气的质量一定小于氦气的质量
(D)同温同压下,若两者的物质的量相等,则其体积也相等
5.某元素1个原子的质量为a,1个12C原子的质量为b,阿伏加德罗常数为NA,则该元素的相对分子质量是 ( )
(A)![]() (B)
(B)![]() (C)
(C)![]() (D)a·NA
(D)a·NA
6.下列关于摩尔质量的叙述正确的是 ( )
(A)摩尔质量是1 mol物质的质量
(B)以g/mol为单位时,在数值上摩尔质量与相对分子质量或相对原子质量相等
(C)水的摩尔质量等于NA个水分子的相对分子质量之和
(D)单位物质的量的物质所具有的质量叫摩尔质量
7.配制一定物质的量浓度的某溶液,下列情况,会使配制的结果偏高的是 ( )
(A)未冷却即转移、定容 (B)未洗涤烧杯和玻璃棒
(C)定容时仰视刻度线观察液面 (D)容量瓶中原来含有少量蒸馏水
8.关于容量瓶的四种叙述:①是配制准确浓度的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是 ( )
(A)①②③④ (B)②③ (C)①②④ (D)②③④
9.体积相同的MgCl2溶液和AlCl3溶液中的Cl-个数若相同,则可推知MgCl2和AlCl3溶液物质的量浓度之比为 ( )
(A)1∶1 (B)1∶2 (C)2∶3 (D)3∶2
10.300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1 mol/L NaOH溶液,应取原
溶液与蒸馏水的体积比约为 ( )
(A)1∶4 (B)1∶5 (C)2∶1 (D)2∶3
11.已知:碘(I)元素有-1、+1、+3、+5、+7等多种化合价。碘酸碘是由带正电荷的碘离子和碘酸根离子(IO-3)构成。你认为它的化学式可能是下列中的 ( )
(A)I2O5 (B)I2O7 (C)I4O5 (D)I4O9
12.下列化学反应中,不属于四种基本反应类型的是 ( )
|
(C)Cu2(OH)2CO3 2CuO+H2O+CO2↑
(D)4Fe(OH)2+2H2O+O2
4Fe(OH)3
13.下列叙述正确的是 ( )
(A)有单质生成的分解反应一定是氧化还原反应
(B)氧化剂在反应中失去电子
(C)还原剂在反应中发生还原反应
(D)氧化反应和还原反应不一定是同时发生的
14.在下列化学方程式中,不能用离子方程式Ba2++SO![]()
BaSO4↓来表示的是 (
)
(A)Ba(NO3)2+H2SO4 BaSO4↓+2HNO3
(B)BaCl2+2Na2SO4 BaSO4↓+2NaCl
(C)BaCO3+H2SO4 BaSO4↓+H2O+CO2↑
(D)BaCl2+H2SO4 BaSO4↓+2NaCl
15.下列离子方程式中,正确的是 ( )
(A)稀盐酸滴在铜片上:Cu+2H+
Cu2++H2↑
(B)稀硫酸与氢氧化钡溶液反应:Ba2++SO![]()
BaSO4↓
(C)氧化铜与稀硫酸混合:CuO+2H+ Cu2++H2O
(D)硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH- Cu(OH)2↓+SO![]()
16.下列有关Na2CO3和NaHCO3性质的比较中,不正确的是 ( )
(A)对热的稳定性:Na2CO3>NaHCO3
(B)常温时水溶性:Na2CO3>NaHCO3
(C)相对分子质量:Na2CO3>NaHCO3
(D)与相同浓度的稀酸反应产生CO2的快慢:Na2CO3>NaHCO3
17.在100mL 0.10mol/L的AgNO3溶液中加入溶有2.08g BaCl2的溶液,再加入100mL 0.10 mol/L CuSO4·5H2O的溶液,充分反应。下列说法正确的是 ( )
(A)最终得到白色沉淀和无色溶液
(B)最终得到白色沉淀是等物质的量的两种化合物的混合物
(C)在最终得到的溶液中,Cl-的物质的量浓度为0.01 mol/L
(D)在最终得到的溶液中,Cu2+的物质的量浓度为0.01 mol/L
18.在相同体积、相同物质的量浓度的溶液中,必然相等的是 ( )
(A)溶质的质量 (B)溶质的物质的量
(C)溶质离子的物质的量浓度 (D)溶质的质量分数
19.1820年,德贝莱纳用MnO2催化KClO3分解制O2发现制得的氧气有异常气味,将该气体通过淀粉碘化钾溶液,溶液变蓝。则所制得的氧气中可能混有 ( )
(A)Cl2 (B)Br2 (C)I2 (D)HCl
20.绝大多数盐类是强电解质,而醋酸铅是弱电解质。能证明醋酸铅是弱电解质的方法是
( )
①比较相同浓度的醋酸铅和硫酸镁溶液的导电性
②硫酸铅沉淀中加入醋酸铵,沉淀消失
③测定醋酸铅的熔点
④测定醋酸铅的溶解度
(A)①② (B)①③ (C)②④ (D)③④
第Ⅱ卷(非选择题 共40分)
二、填空题(共20分)
21.下表是某地市场上销售的一种加碘盐包装袋上的部分文字说明。请根据此表,结合学过的化学知识,回答下列问题:
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘量 | 20mg/kg~40mg/kg |
| 贮藏方法 | 密封避光、防潮 |
| 食用方法 | 烹调时待食品熟后加入碘盐 |
(1)碘酸钾属于哪类化合物?答: (填:“酸”、“碱”、“盐”或“氧化物”)。
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时 。
22.法医做指纹显影实验时,先对准指纹处喷洒AgNO3溶液,使之与人体分泌出的汗水中的某种离子结合,然后进行光照处理,就可显出指纹。请回答:
(1)指纹显影实验的原理是: 。
(2)整个实验过程中所发生的化学方程式为 。
23.下列物质间在一定条件下可实现如图所示的一系列变化,其中A是中学化学中常见的单质气体,且实验室可用固体X和黑色固体Y共热来制备气体A;固体B为混合物,白色沉淀D难溶于稀硝酸,E的焰色反应是显紫色(透过蓝色钴玻璃),H加热生成固体Y和水。请填写下列空白:
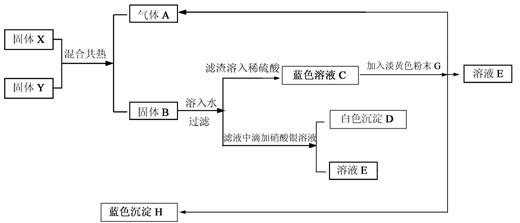
(1)X是(填化学式,下同) ,Y是 ,E是 。
(2)写出下列反应方程式(是离子反应的写出离子反应方程式):
①X、Y共热 ;
②滤渣与稀硫酸反应(离子方程式) ;
③C与淡黄色粉末反应生成A、F、H(离子方程式);
三、实验题(共10分)
24.(1)实验室有下列仪器:
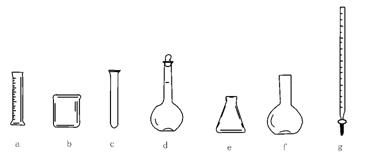
请从a~g中选择适当的装置填空。
①有零刻度且刻度在上方的是 ;
②不需要垫石棉网就可以直接加热的是 ;
③可以作为反应容器的是 。
(2)草木灰中含有K2CO3,海藻灰中含有碘盐。从草木灰中提取碳酸钾,从海藻灰中提取碘,并做有关检验:
①为测定草木灰中碳酸钾含量,需配制一定物质的量浓度的溶液。配制前检查容量瓶是否漏水的方法是: 。
②从草木灰中提取钾盐。过滤后的溶液在蒸发皿里加热以得到钾盐晶体。加热过程中要 ,当蒸发到 时停止加热。
③用焰色反应检验K+。某学生用光洁的铂丝去蘸碳酸钾粉末,却蘸不上,这是因为 ,某学生采用正确的方法观察到了紫色,能否判断有无Na+存在 。
④将Cl2通入海藻灰溶液,溶液变为浅棕色。将CCl4加入溶液中,充分振荡,静置分层后,下层液体的颜色是 ,有关反应的离子方程式是 。
四、计算题(10分)
25.往KI溶液中慢慢加入AgNO3溶液,直到反应完全为止,过滤,测得反应后溶液的质量恰好等于原碘化钾溶液的质量。
求:该AgNO3溶液中溶质的质量分数。
参考答案
一、选择题
1.(D) 2.(C) 3.(D) 4.(B)(D) 5.(B) 6.(B)(D) 7.(A) 8.(A) 9.(D) 10.(A) 11.(D) 12.(B) 13.(A) 14.(C) 15.(C) 16.(D) 17.(B) 18.(B) 19.(A) 20.(A)
二、填空题
21.(1)盐 (2)易分解
22.(1)汗液的Cl-与加入的Ag+结合成AgCl,而AgCl见光分解生成颗粒状银(黑色),从而显示指纹。
|
2AgCl 2Ag+Cl2↑
![]() 23.(1)KClO3;CuO;KNO3;
23.(1)KClO3;CuO;KNO3;
(2)①2KClO3 2KCl+3O2↑
②CuO+2H+ Cu2++H2O
③Cu2++Na2O2+H2O Cu(OH)2↓+2Na++![]() O2↑
O2↑
三、实验题
24.(1)①g;②c;③b c e f
(2)①往瓶内加入一定量水,塞好瓶塞。用食指摁住瓶塞,另一手托住瓶底,将瓶倒立,观察瓶塞周围是否漏水。若不漏水,将瓶正立,瓶塞旋转180℃后塞紧,再重复一次上述操作,若仍不漏水,此容量瓶即可使用。
②用环棒不断搅拌;大量晶体析出;
③铂丝未用蒸馏水润湿或未制成螺旋状;不能
④紫红色;2I-+Cl2 2Cl-+I2。
四、计算题
25.答案:72.3%
解析:由题意知:KI+AgNO3=AgI↓+KNO3。过滤后溶液的质量恰好等于原碘化钾溶液的质量,即所得到的AgI沉淀的质量等于所加入的AgNO3溶液的质量。要把AgI与AgNO3联系起来,可知它们的物质的量相等。
AgNO3溶液中AgNO3的物质的量为x,AgI的物质的量也为x。
m(AgNO3)=170g/mol·x
m[AgNO3(aq)]=m(AgI)=235 g/mol·x
W(AgNO3)=![]() =72.3%。
=72.3%。