高一年级化学上学期期末联考试卷
化学试卷
注意事项:
1.本试卷共4页,满分110分,考试时间90分钟
2.答卷前,考生必须在试卷答题卡的密封线内填写自己所在学校、姓名、班级、考号
3.将第I卷和第II卷的答案均填写在试卷答题卡相应的位置上
4.答题时可能用到的相对原子质量(原子量):H-1 C-12 O-16 F-19 Cl-35.5 Li-7 Na-23 K-39 Rb-85.5 Cs-133
第I卷(共54分)
以下1至18题,每小题给出的四个选项中,只有一个选项符合题意。每小题3分,共54分。
1.2007年12月中央召开的经济工作会议上提出我国当前国民经济建设中要大力抓好节能降耗、保护环境。下列举措中违背了这一指导思想的是
A.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
B.研制乙醇汽油(汽油中添加一定比例的乙醇)技术,降低机动车辆尾气中有害气体排放
C.生产和生活中,努力实现资源的循环利用
D.利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求
2.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟,应理解为
A.单质 B.分子 C.元素 D.氧化物
3.下列关于摩尔的叙述中正确的是
A.摩尔是物质质量的单位
B.摩尔是物质数量的单位
C.摩尔既表示物质微粒数量,又表示物质质量,是具有双重意义的单位
D.摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
4.下列物质属于纯净物的是
A.漂白粉 B.氯水 C.液氯 D.盐酸
5.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,2.24L水含有NA个水分子
B.氧气和臭氧的混合物3.2 g中含有NA个氧原子
C.7.8 g Na2O2与水反应时转移0.1NA个电子
D.1.12 L氯气中含有NA个氯原子
6.下列有关氧化还原反应的叙述正确的是
A.肯定有一种元素被氧化,另一种元素被还原
B.在反应中一定所有元素的化合价都发生变化
C.置换反应一定属于氧化还原反应
D.化合反应和分解反应中不可能有氧化还原反应
7.实验室制氯气时有如下操作,操作顺序正确的是
⑴ 连接好装置,检验气密性 ⑵ 缓慢加热,加快反应使气体均匀逸出 ⑶ 在烧瓶中加入MnO2粉末 ⑷ 往分液漏斗中加入浓盐酸,再缓慢滴入烧瓶中 ⑸用向上排空气法收集氯气,尾气导入吸收试剂中
A.⑴⑵⑶⑷⑸ B.⑷⑶⑴⑵⑸ C.⑴⑶⑷⑵⑸ D.⑴⑷⑶⑵⑸
8.根据阿伏加德罗定律,下列叙述中正确的是
A.同温同压下,两种气体的体积之比等于摩尔质量之比
B.同温同压下,两种气体的物质的量之比等于密度之比
C.同温同压下,两种气体的摩尔质量之比等于密度之比
D.同温同压下,两种气体的物质的量之比等于质量之比
9.下列关于卤族元素随核电荷数的递增,由上到下性质递变的叙述,正确的是
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④ C.②④⑤ D.①③⑤
10.钾和另一种碱金属组成的混合物共8 g与水完全反应后放出0.4g氢气,混合物中另一种金属一定是
A.锂 B.钠 C.铷 D.铯
11.下列贮存化学试剂的方法正确的是
A.新制的氯水保存在棕色广口瓶中,并放在阴凉处
B.用做感光片的溴化银贮存在无色试剂瓶中
C.烧碱溶液放在带磨口玻璃塞的试剂瓶中
D.保存液溴时应用水进行液封
12.根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后,Na2SO3转化为
A.Na2SO4 B.SO2 C.S D.Na2S
13.将19g F2通入81g水中,所得溶液中溶质质量分数是
A.19% B.20% C.21.7% D.27.5%
14.关于Na2CO3和NaHCO3的说法正确的是
A.在水中的溶解性:NaHCO3>Na2CO3
B.与质量分数相同的盐酸溶液反应放出气体的快慢:NaHCO3<Na2CO3
C.热稳定性:NaHCO3<Na2CO3
D.等质量的固体与足量盐酸反应放出CO2的质量Na2CO3>NaHCO3
15.体积为VmL,密度为ρg·mL-1的溶液,含有相对分子质量为M 的溶质m g.其溶液的物质的量浓度为c mol·L-1,质量分数为a%.下列表示式中正确的是
A.c= 1000aρ/M B.m= 100ρV a% C.m=1000aρ/M D.c=1000m/(V M)
16.根据碱金属的性质变化规律可推测铯的性质,下列推测错误的是
A.灼烧CsCl时,火焰有特殊的颜色 B.CsNO3易溶于水
C.在钠、钾、铯三种单质中,铯的熔点最低 D.CsOH是弱碱
17.下列离子方程式中书写正确的是
A.氢氧化钾溶液与盐酸反应:KOH + H+=H2O + K+
B.用氢氧化钡溶液中和硫酸溶液:Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓
C.氯气溶于氢氧化钠溶液:Cl2+OH-=Cl-+ClO-+H2O
D.在澄清石灰水中通入过量的CO2:Ca2++2OH-+2CO2=Ca(HCO3)2
18.将100g KHCO3和 K2CO3的混合物加热到质量不再变化时,剩余固体的质量为81.4g,则此混合物中K2CO3的质量分数是
A.24% B.60% C.50% D.40%
第II卷(共56分)
19.(本题共18 分) A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外单质B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
⑴写出A、B、C、D、E、F的化学式
A ;B ;C ;D ;E ;F ;
⑵写出F和H反应的化学方程式: 。
⑶写出下列反应的离子方程式:
① D+盐酸 。
② B+水 。
20.(本题共10分) 在盛有NaI、AgNO3、CaCl2、K2CO3、HBr的已失去标签的五种无色溶液的试剂瓶上,分别贴上①②③④⑤的编号,使它们两两反应,产生的现象在下表中列出。请在表中的结论格内,填写这些编号所代表的物质的化学式。
| ① | ② | ③ | ④ | ⑤ | |
| ① | —— | 无色↑ | 白色↓ | 白色↓ | 无 |
| ② | 无色↑ | —— | 无 | 浅黄↓ | 无 |
| ③ | 白色↓ | 无 | —— | 白色↓ | 无 |
| ④ | 白色↓ | 浅黄↓ | 白色↓ | —— | 黄色↓ |
| ⑤ | 无 | 无 | 无 | 黄色↓ | —— |
| 结论 |
21.(本题共8分) ⑴某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水。
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色。
依据溶液颜色的变化,判断加入以上药品的顺序是(填写序号)
呈棕黄色时发生反应的离子方程式是
⑵溴化钠和较浓硫酸微热时可生成一种无氧酸X和一种酸式盐,该酸式盐的化学式是
X的浓溶液和二氧化锰共热时的化学方程式是
22.(本题共8分) 实验室配制500 mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;②把①所得溶液小心转入500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度2~3厘米处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
⑴实验操作步骤的正确顺序为(填序号) 。
⑵本实验两次用到的玻璃仪器是 。
⑶若没有进行操作④所配溶液浓度 (填“偏高”,“偏低”或“不变”)。
⑷若实验过程中加蒸馏水时不慎超过了刻度如何处理?
23.(本题共8分) ⑴已知某双原子分子构成的气体,其摩尔质量为Mg·mol-1。
①该气体在标准状况下的密度为 g·L-1。
②该气体一个分子的质量为 g(NA表示阿伏加德罗常数的值,用含有NA的代数式来表示)
⑵ A物质Wg在氧气中完全燃烧后,其产物再与足量的固体过氧化钠充分反应,固体质量增加了Wg, 则A可能是下列中的 (填序号)。
① CH4 ②CO ③H2 ④CH3COOH
⑶ B物质由碳、氢、氧三种元素组成,其分子中含碳原子m个,含氢原子2n个。B物质Wg在氧气中完全燃烧后其产物再与足量的固体过氧化钠充分反应,固体质量增加了Wg,则B的分子式可表示为
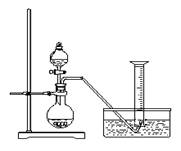 24.(本题共4分) 某同学设计实验方案来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况)。以下是实验方案的一部分。
24.(本题共4分) 某同学设计实验方案来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况)。以下是实验方案的一部分。
实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑
通过测定生成的氧气的体积,经计算可确定样品中过氧化钠的含量。
实验步骤:
①称取过氧化钠样品2.00 g ;
②把这些过氧化钠样品放入气密性良好的气体发生装置中;
③向过氧化钠样品中滴入水,用量筒排水集气,量筒内液面在110 mL处恰与水槽内液面相平;
④ 作为反应器的烧瓶中有54.0 mL液体;
⑤ 将烧瓶内的液体转移到250 mL的容量瓶内,并加水定容。
请回答下列问题:
⑴有1000 mL、 500 mL 、250 mL的量筒备用,则应选用 mL的量筒。
⑵生成气体体积是 mL, 为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是
⑶据研究,与上述反应同时发生的反应还有:Na2O2 + 2H2O = 2NaOH + H2O2,H2O2的生成会使测定结果 (填“偏高”、“偏低”或“无影响”)。
高一年级化学上学期期末联考试卷
化学试卷参考答案及评分标准
1D 2C 3D 4C 5C 6C 7C 8C 9C 10A 11D 12A 13C 14C 15D 16D 17B 18D
19.(每空2分 共18 分)
⑴ A、NaOH B、Na C、Na2CO3 D、NaHCO3 E、NaCl F、Na2O2
⑵ 2Na2O2+2CO2=2Na2CO3+O2
⑶ ① D+盐酸 HCO3- + H+ = CO2↑ + H2O
② B+水 2Na + 2H2O = 2Na+ + 2OH- + H2↑
20.(每空2分 共10分)①~⑤分别为K2CO3、HBr、CaCl2、AgNO3、NaI。
21.(每空2分 共8分)
⑴ A→E→B→C→D 2I-+Cl2=Cl-+I2
⑵ NaHSO4
4HBr(浓)+MnO2![]() MnBr2+2H2O+Br2↑
MnBr2+2H2O+Br2↑
22.(每空2分 共8分)
⑴ ①②④③⑤
⑵ 玻璃棒
⑶ 偏低
⑷ 重新配制
23.(每空2分 共8分)
⑴ ①M/22.4 ②M / NA
⑵ ②③④
⑶ CmH2nOm (其他合理答案同样给分)
24.(每空1分 共4分)
⑴ 500 mL
⑵ 56 mL 使量筒内外液面持平;视线平视溶液凹液面底部,与刻度线相切
⑶ 偏低
高一年级化学上学期期末联考试卷
化学试卷答题卡
| 题号 | 1-18 | 19 | 20 | 21 | 22 | 23 | 24 | 总分 |
| 得分 |
将1至18题的正确答案用2B铅笔填写在以下答题卡上
|
19. ⑴写出A、B、C、D、E、F的化学式
|
19. ⑴A ;B ;C ;D ;E ;F ;
⑵写出F和H反应的化学方程式:
⑶写出下列反应的离子方程式:
①
②
|
20.① ② ③
④ ⑤
|
21. ⑴ 顺序是(填写序号)
反应的离子方程式是
⑵化学式是
化学方程式是
|
22.⑴ 。
⑵ 。
⑶ (填“偏高”、“偏低”或“不变”)。
⑷
|
23. ⑴ ① 密度为 g·L-1。
② 该气体一个分子的质量为 g
⑵ (填序号)。
⑶ B的分子式可表示为
|
24. ⑴ 选用 mL的量筒。
⑵体积是 mL,
⑶ (填“偏高”、“偏低”或“无影响”)。