高一年级化学必修1第四单元考试
化学试题
可能用到的相对原子质量:
H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27 S—32 Cl—35.5 Cu—64
第Ⅰ卷(选择题 共60分)
一、选择题(每小题4分,共60分;每小题只有一个选项最符合题意)
1、空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施中,不利于“蓝天工程”建设的是 ( )
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的使用量
2、油炸虾条、薯片等挤压易碎的食品不宜采用真空包装,一般在包装袋中充入某种气体防止食品被直接挤压,你认为下列气体中,最宜充入包装袋的是 ( )
A.氮气 B.氧气 C.氯气 D.氢气
3、下列物质互为同素异形的是( )
A.CaCO3和MgCO3 B.CO和CO2 C.C60 和C70 D 1H和2 H
4、向0.1mol·L-1 NaOH溶液中通入过量的CO2后,溶液中存在的主要离子是( )
A.Na+和CO32+ B.Na+和HCO3+ C. CO32+和HCO3+ D.Na+和OH-
5、我国城市环境中的大气污染物主要是 ( )
A.CO2 、Cl2 、 N2 、酸雨 B.SO2 、CO、 NO2 、烟尘
C.NH3、CO、 NO2 、雾 D.SO2 、HCl、 N2 、粉尘
6、下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是( )
①Na+H2O ②NO2+H2O ③CO2+H2O ④Na2O+H2O ⑤Cl2+H2O
A ①③ B ③④ C ③⑤ D ②⑤
7、将盛有NO2 和N2 混合气体的试管倒立于水中,经过足够长的时间后,试管内气体体积缩小为原体积的一半,则原混合气体中氮气与二氧化氮的体积比 ( )
A、1:1 B、1:2 C、1:3 D、3:1
8、把一小块钠投入浓氨水中,逸出的气体是 ( )
A.全为H2 B.全为NH3 C.H2和NH3 D.NH3·H2O
9、已知某溶液中存在较多的H+、SO42+ 、NO3- ,则溶液中还可能大量存在的离子组成( )
A.Al3+、CH3COO-、Cl- B.Na+、NH4+、Cl- C. Mg2+、Cl-、Fe2+ D. Mg2+、Ba2+、Br-
10、下列有关试剂的保存方法,错误的是 ( )
A.浓硝酸保存在无色玻璃试剂瓶中 B.氢氧化钠溶液保存在有橡皮塞的玻璃试剂瓶中 C.新制的氯水通常保存在棕色玻璃试剂中 D.少量的钠保存在煤油中
11、为了除去CO2中含有少量的SO2 气体,可以使气体通过 ( )
A. Na2CO3溶液 B.H2SO4溶液 C.NaHCO3溶液 D.Ba(OH)2溶液
12、向NaI和Na Br的混合溶液中通入过量的Cl2 ,充分反应后将溶液蒸干,灼热残余物,最后剩下的物质是 ( )
A.NaCl、I2、Cl2 B. NaCl、I2 C. NaCl、Na Br D. NaCl
13、1L稀H2SO4 和稀H NO3的混合液,其物质的量浓度分别为0.4mol·L-1和0.1mol·L-1。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A.2.4g B.3.2g C.6.4g D.9.6g
14、下列反应的离子方程式书写中,正确的是 ( )
A.硫酸与氢氧化钡在溶液中反应: Ba2++SO42— BaSO4↓
B.用Cl2将苦卤中的Br—氧化: Cl2+Br—=Cl—+Br2
C.用小苏打治疗胃酸过多: HCO3—+H+=CO2↑+H2O
D.用FeCl3溶液腐蚀铜箔制造印刷电路板: Fe3++Cu=Fe2++Cu2+
15、现有下列反应式,据两式判断,下列各组离子中,还原性由强到弱的排列顺序正确的是
( )
(1)2Fe3++2I— 2Fe2++I2
(2)Br2+2Fe2+ 2Fe3++2Br—
A.Br—>Fe2+>I— B.I—>Fe2+>Br—
C.Br—>I—>Fe2+ D.Fe2+>I—>Br—
将选择题答案填入下表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
二、填空题(本题饭知3小题,共14分)
16.(共3分)在同温同压下,在相同体积的CO和CO2中,分子个数之比为 ,氧原子个数之比为 ,密度之比为 。
17.(6分)Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是 ,反应的化学方程式为 ;若NaHCO3溶液中混有少量Na2CO3杂质,除去杂质的方法是 。
|
|
三、推断题(本题包括2小题,共20分)
18、(共9分)如图所示
+HCl +Na2O2① +Cu
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() A
D
A
D
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() x加热 B
F
G
x加热 B
F
G
+NaOH +D 催化剂② +Cu
![]()
![]()
![]()
![]()
![]() C
E
C
E
图中每个字母表示有关的一种反应物或生成物,其中A、C为无色气体。请填写下列空白:
(1) 物质X可以是————————————,C是——————,F是——————
(2) 反应①的化学方程式是————————————————————————————————————————
反应②的化学方程式是————————————————————————————————————————
18 X:(NH4)2CO3 或NH4HCO3 C:NH3 F:NO2
2CO2 + 2Na2O2 = 2Na2CO3 + O2↑
4NH3 + 5 O2 = 4 NO + 6H20(条件是加热、催化剂)
19.(6分)某校的研究性学习小组进行测定混合物各组分质量比的研究,甲、乙、丙三位同学各设计了一种实验方案如下表所示:(混合物的质量事先已称量好)
| 实验 序号 | 混合物 | 第一步:加入适量水,充分溶解 | 第二步:加入或通入的试剂 | 第三步:过滤后洗涤干燥所得固体 | 第四步:蒸发滤液得到晶体 | 第五步:称量,记录数据 |
| 甲 | BaCl2 NaCl | 澄清溶液 | 过量CO2 | 无固体 | 晶体 | 称量所得 晶体 |
| 乙 | CaCl2 NaCl | 澄清溶液 | 过量饱和 Na2CO3溶液 | CaCO3 | NaCl | 称量蒸发 所得晶体 |
| 丙 | Na2SO4 MgSO4 | 澄清溶液 | 过量NaOH 溶液 |
试回答下列问题:
①你认为甲同学设计的实验步骤中,根据称量所得到的数据, (填“能”或“不能”)准确计算出混合物中各组分的质量比。
②经讨论大家认为,乙同学所设计的实验步骤的第四步填写一定有错误。其原因是什么? 。
③丙同学对实验进行了较合理的设计,将其后三步相应内容仿照前面的形式填入对应的空格内。
19.(共6分,每空(项)1分)
①不能 ②第二步加入的碳酸钠溶液为过量的,最后所得晶体中应有碳酸钠存在
| 丙 |
| Mg(OH)2 | NaOH Na2SO4 | 称量过滤所得Mg(OH)2固体 |
③
20.(16分)请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实
验中发生的有关问题。
Ⅰ.探究上述四种酸氧化相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸
④稀硝酸,能随即发生反应的是(填序号,下同) ,微热则发生反应的是 ,加热后发生反应的是 ,加热也不发生反应的是
。由此可以得到上述四种酸氧化性由强到弱的顺序是:
|
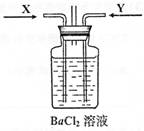
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是
A.HNO3的酸性比H2SO4强
B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸
D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
|
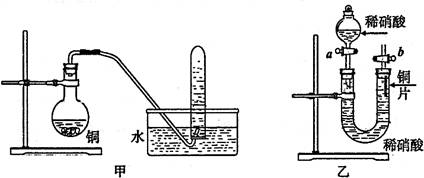
(1)写出铜和稀硝酸反应的离子方程式 。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体 (填:“能”或“不能”),请简述理由(包括化学方程式)是
(3)若用实验装置乙进行实验,检查装置气密性的操作是
20(共16分)
I.(1)每空1分,共5分。 ③、④、①、②;③>④>①>②
(2)每项1分,共2分(每错答l项倒扣1分)。 B C
(3)答出4项得2分,答出3项得1分,答出1项和2项的不得分(每错答1项倒扣1分)。
B C D E
Ⅱ(1)3Cu+8H++2NO3—=3Cu+2NO![]() +4H2O(2分)
+4H2O(2分)
(2)不能(1分),因为烧瓶内有氧气,能氧化NO气体生成红棕色的NO2(1分), 2NO+O2=2NO2(1分)。
(3)关闭活塞b打开活塞a,通过分液漏斗向U型管内加水,若加入少最水后漏斗中的水不再下滴并能保持此状态一段时问,则说明该装置的气密性良好(2分)。