高一年级化学期末模拟测试
第I卷(选择题 共48分)
可能用到的原子量:H—1 O—16 Na—23 Mg—24 Zn—65 S—32
Cu—64 Fe—56
一、选择题(本题包括16小题,每小题3分,共48分。每小题有一个符合题意)
1、 2008年将在我国北京举行夏季奥运会,这次奥运会提出要突出“绿色奥运、科技奥运、人文奥运”的理念,其中绿色奥运是指
A.运动员的食品全部是未加任何添加剂的食品
B.所有奥运用品全部是天然绿色植物
C.奥运场馆建设均使用天然材料建造,不使用人工合成材料
D.把环境保护作为奥运设施规划和建设的首要条件
2、实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
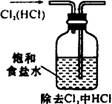

A B C D
3、现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,只用一种试剂就能够将它们区别开,这种试剂是
A.氨水 B.AgNO3 C.浓NaOH D.NaCl
4.物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是 ( )
A.常温下,“纳米铜”与铜片的还原性相同 B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”比铜片的金属性强 D.常温下,“纳米铜”比铜片的氧化性强
5、实验室中,加入过量的下列试剂,可使AlCl3溶液中的Al3+全部沉淀出来的是
A.NaOH溶液 B.AgNO3溶液 C.盐酸 D.氨水
6、下列反应,其产物按红、红褐、淡黄的顺序排列的是
①金属钠在纯氧气中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液
A.②③① B.③②① C.③①② D.①②③
7、通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是 ( )
|
| 现象 | 解释 |
| A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
8、下列离子方程式中书写正确的是
A.金属钠与水反应:Na +2H2O=Na++2OH-+H2↑
B.用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-=H2O+BaSO4↓
C.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
D.在澄清石灰水中通入过量的CO2:Ca2++2OH-+2CO2=Ca(HCO3)2
9、下列有关实验的说法正确的是
A.除去铁粉中混有的少量铝粉.可加人过量的氢氧化钠溶液,完全反应后过滤
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32-
10、向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)
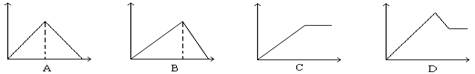
11、向两烧杯中分别加入等足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A 1︰2 B 3︰2 C 3︰1 D 6︰1
12、若NA表示阿佛加德罗常数,下列说法正确的是( )
(A)1 mol Cl2作为氧化剂得到的电子数为NA
(B)在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
(C)14 g氮气中含有7NA个电子
(D)NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4
13、高铁酸钾 (K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:2Fe(OH)3 +3ClO -+4OH- =2FeO42- +3Cl- +5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
下列有关说法不正确的是:
A. 高铁酸钾中铁显+6价
B. 湿法中每生成1mol Na2FeO4 转移3mol电子
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质
14.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
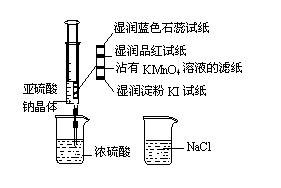 A.蓝色石蕊试纸先变红后褪色
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液
滤纸均褪色证明了SO2漂白性
C.湿润淀粉KI试纸未变蓝说明
SO2的氧化性弱于I 2
D.NaCl溶液可用于除去实验中
多余的SO2
15.下列叙述正确的是
A.常温常压下,5.6 L NH3的物质的量为0.25 mol
B.0.5 mol H2的质量为1 g,体积为11.2 L
C.40 g NaOH溶于1 L水中,得到的溶液物质的量浓度为l mol·L-1
D.9 g H2O中氧原子数与8 g O2中氧原子数相等
16.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( )
A.H3O+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
第II卷(非选择题 共52分)
二、(本题包括2小题,共24分)
17、(9分)实验室需配制4.6 mol·L-1的H2SO4溶液0.5 L。
⑴ 需要浓度为18.4 mol·L-1的浓硫酸 mL;
⑵ 需要用的玻璃仪器除玻璃棒、量筒外还有 ;
⑶ 配制过程中下列操作导致溶液浓度偏高的是 。
(A)移液时未充分洗涤烧杯和玻棒
( B)移液时未用玻棒引流而使少量液体外溢
(C)定容俯视刻度线
18、(15分)某研究性学习小组的同学对Cl2使有色物质褪色的机理进行了探究。
甲同学设计了如下图所示的实验装置并进行实验:
![]()
![]()
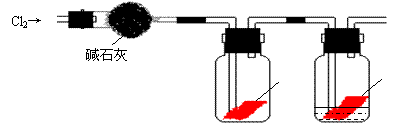
⑴ 甲同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因 ;
⑵ 甲同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是 ,由此得出Cl2使有色物质褪色的机理是 。
⑶ 乙同学认为甲设计的实验装置即使改进后还缺少一部分。请你将乙认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂的名称。
⑷ 请你写出Cl2和“③”中“最合适的化学试剂”反应的离子方程式 。
三、(本题包括2小题,共14分)
19.(7分)A—L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物,E的溶液遇到KSCN溶液变成红色。A—L各物质之间相互反转化的关系如图所示(未注明必要的反应条件)。请回答:
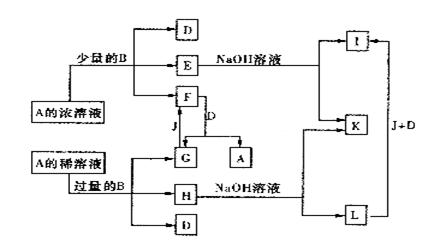 |
(1)B和A的浓溶液反应的条件是________,而常温下反应难以进行的原因是 ________________________________________________。
(2)写出F和G相互转化的化学方程式:
F→G:_______________________;G→F:______________________。
(3)写出E→I 的离子方程式:_____________________________________。
(4)L转化成 I 的现象是____________________________,有关反应的化学方程式为 ___________________________。
20.(7分)化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
⑴ 硅是无机非金属材料的主角。请你举出两种含硅的材料名称 、 。
⑵ 大量使用化石燃料的最直接的危害是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关。请你举出两种防治酸雨的措施 、 。
⑶实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种试剂一次鉴别它们。甲同学选的是一种正盐溶液,乙同学选的是一种有色试剂,他们都得到了正确结论。试推断甲、乙两位同学选用的试剂:
甲 __________ ,乙 _________ 。还可以用__________。(均填名称)
四、(本题包括1小题,共14分)
21.(6分)把19.2 g 的Cu放入足量的稀硝酸中,微热至Cu完全反应。求:
⑴ 19.2 g Cu的物质的量;
⑵ 参加反应的硝酸的物质的量;
⑶ 生成的NO在标准状况下的体积;
22.(8分) 将一定质量的铁粉加入到装有100 ml某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 ml(标准状况下)。
①所得溶液中的溶质的化学式是______________;
②原硝酸溶液的物质的量浓度为:________________ mol/L。
(2)向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式是 ____________ ;
②m-n的值为(计算精确到0.1g)____________ g 。
高一年级化学期末模拟测试
化学试题答题卷 2008/01
班级________________姓名________________总分_________________
温馨提示:
1、请将第I、 II卷答案按要求写在指定位置;
2、交卷时只交答题卷;
第I卷答题卷(共48分) 得分:_____________
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第II卷答题卷(非选择题 共 52分)
成绩统计表(考生不要填写)
| 题号 | 17 | 18 | 19 | 20 | 21 | 22 | 总分 |
| 得分 |
|
|
|
|
|
|
|
17、(9分)(1)_____________________(2)_______________________,(3)______________,
 18、(15分)
18、(15分)
⑴ ____________________________
⑵ ____________________________________________⑶ (如图)
⑷ ___________________________________________
19.(7分)(1)________________ __________________________________
(2)____________________________________、_______________________________
(3)__________________________________________
(4)____________________________________________________
________________________________________________________________
20、(6分)
(1)______________________________、______________________________________
(2)_______________________________、______________________________________
(3)________________、________________________、________________________
21、(6分)要求:有必要的计算步骤:
(1)
(2)
(3
22.⑴ ①_____________________ ② ________________________
⑵ ①_____________________ ② _______________________
高一年级化学期末模拟测试
化学试题参考答案 2008.1
一、选择题(共48分,每题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | C | A | D | B | B | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | D | B | C | C | C | D | A |
二、非选择题(共52分)
17.(6分,每空3分)
⑴ 125.0
⑵ 500mL容量瓶、烧杯、胶头滴管
⑶ C
18.(15分,每空3分)
![]()
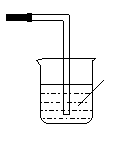
⑴ 使用的干燥剂碱石灰将Cl2吸收
⑵ 干燥的有色布条不褪色,湿润的有色布条褪色
Cl2和水反应生成次氯酸,次氯酸具有漂白作用
⑶ (如图)
⑷ Cl2+2OH-=Cl-+ClO-+H2O
19.(1)加热 浓硝酸在常温下使铁表面“钝化”
(2)![]()
![]() (3)
(3)
![]() (4)白色沉淀,迅速变成灰绿色,最后变成红褐色
(4)白色沉淀,迅速变成灰绿色,最后变成红褐色
20.(8分,每空1分)
⑴ 玻璃、水泥、混凝土、陶瓷、光导纤维等
⑵ 推广原煤脱硫技术、改进燃烧技术,减少燃煤过程中SO2等废气的排放、推煤燃烧后的烟气脱硫、调整能源结构,发展和使用清洁能源、加强环境管理,强化环保执法,严格控制SO2的排放量等
(3)碳酸钠 紫色石蕊 碳酸氢钠(其他合理答案也可以)
21、解: ⑴ n(Cu)=![]() =0.3 mol (2分)
=0.3 mol (2分)
⑵ 3Cu + 8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 8
0.3 mol n(HNO3)
![]()
n(HNO3)=0.8 mol (2分)
⑶ 3Cu +8HNO3=3Cu(NO3)2+ 2NO↑ +4H2O
3mol 44.8L
0.3 mol V(NO)
![]()
V(NO)=4.48 L (2分)
22.⑴ ①Fe(NO3)2 ② 0.8 ⑵ ①FeSO4 ② 5.0