高一化学第一学期期末试卷
说明:①本卷考试时间为100分钟,满分为100分
②请在答题卷的右下角填写正确的座位号
③请将选择题的正确答案用2B铅笔涂在答题卡上,考试完毕答题卡与答题卷一并交给监考老师,本卷学生自己保存
④可能用到的相对原子质量
H-1 C-12 O-16 S-32 Cl-35.5 Na-23 Al-27 Fe-56 Cu-64 Mg-24 Zn-65 Ca-40
第I卷(选择题,满分50分)
一、选择题(每小题只有一个正确答案,每小题2分共20分)
1、下列化学式对应的化学俗名正确的是
A.石膏(Na2SO4·10H2O) B. 民矾[KAl(SO4)2·12H2O]
C. 铁洪(Fe3O4) D. 纯碱(Na2CO3)
2、光导纤维的主要成分是
A. SiO2 B. Na2SiO3 C. Si D. SiC
3、根据中央电视台报道,近年来,我国一些沿江城市多次 出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系
A.溶液 B.悬浊液 C.乳浊液 D.胶体
4、下列说法正确的是
A. 摩尔是一种物理量 B. 气体摩尔体积是22.4L/mol
C. 有电子转移的反应一定是氧化还原反应 D. 金属阳离子只能作氧化剂
5、除去SO2中HCl气体最好用下列
A.NaOH溶液 B. NaHSO3溶液 C. Na2SO3溶液 D. AgNO3溶液
6、在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A.H2S+2HNO3=S↓+2NO2↑+2H2O
B.CuO+2HNO3=Cu(NO3)2+H2O
C.4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
D.3Cu+8HNO3=3CuNO3)2+2NO↑+4H2O
7、下列叙述中,正确的是
A.氯化铵加热发生升华现象
B.二氧化硅不与任何碱、任何酸反应
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硝酸在常温下能够使铁、铝等金属表面形成氧化膜而钝化
8、用NA表示阿伏加德罗常数,下列说法不正确的是
A.标况下1mol氢气含有氢分子数为NA
B.0.5molH2O含有的氢原子数是NA
C.1mol钠作为还原剂可提供的电子数为NA
D.0.5 molNa2O2与足量CO2反应转移的电子数为NA
9、纯碱和小苏打都是白色晶体,在日常生活中都可以找到。要在家庭将它们区分开来,下面的方法中可行的是
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
D.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
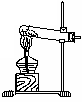 10、利用右图装置可进行下列实验
10、利用右图装置可进行下列实验
A.用NH4Cl和Ca(OH)2制取氨气
B. 用MnO2和浓盐酸制取氯气
C. 用亚硫酸钠与70%硫酸制取二氧化硫
D. 用锌与稀硫酸制取氢气
二、选择题(每小题只有1~2个正确答案,每小题3分共30分)
11、能使血红蛋白失去输氧功能的化合物是
A.NO B. CO C. Cl2 D.SO2
12、下列物质中既能与盐酸反应,又能与NaOH溶液反应的是 ①Na2SiO3②Al(OH)3③NH4HCO3④Al2O3
A.①②④ B. ②③④ C. ②④ D.全部
13、下列反应的离子方程式书写正确的是
A.铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑
B.金属铝溶于氢氧化钠溶液: Al+2OH-=AlO2-+H2↑
C.碳酸氢钠与苛性钠溶液反应:HCO3-+ OH-=CO32-+H2O
D.硫酸氢钠溶液滴到氢氧化钡溶液至溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
14、加热条件下铜不与稀硫酸反应,当加入下列溶液时,铜能溶解的是
A.氢氧化钠 B.硝酸钾 C.氯化铁 D.硫酸铝
15、在pH=1的溶液中,下列各组离子能够大量共存的是
A.Cl-、Fe3+、CO32-、Ca2+ B.NH4+、NO3-、Cl-、K+
C.K+、Ba2+、Cl-、SO42- D.Fe2+、NO3-、Na+、Cl-
16、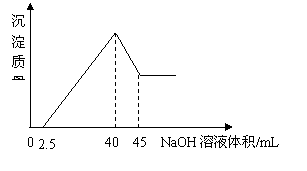 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液,
产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。则原H2SO4物质的量浓度是
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液,
产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。则原H2SO4物质的量浓度是
A.1mol/L B.2mol/L
C.3mol/L D.4mol/L
17、下列有关实验操作或判断正确的是
A. 苯、CCl4、酒精可用来萃取溴水中的溴
B. 制备Fe(OH)2时将取有NaOH溶液的长滴管伸入盛有FeSO4溶液的试管中
C. 配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大
D. 在某盐溶液中加浓NaOH溶液,用玻璃棒蘸取溶液滴在湿润红色石蕊试纸上,试纸变红色证明溶液中含NH4+
18、某干燥的无色混合气体中可能含有Cl2、O2、NH3、NO、NO2、SO2、N2中一种或几种,通过浓硫酸,气体体积减少,后通过碱石灰,气体体积减少,再与空气接触,气体变为红棕色。则下列判断正确的是
A.一定有NH3、NO、SO2 B. 一定没有Cl2、O2、NO2
C.可能有N2 D.以上说法都正确
19、两种金属混合物6.0g,与氯气完全反应,消耗氯气7.1g,则合金的组成可能是
A. Cu和Zn B. Na和Zn C. Fe和Ca D. Cu和Ca
20、mg铜与一定体积18.5mol/L的硫酸加热反应,得到标准状况下SO2 nL, 下列数据表示反应中硫酸作为氧化剂的物质的量(单位为mol),其数据一定正确的是
A. n/22.4 B. m/64 C.m/32 D.98n/22.4
第II卷(非选择题 共50分)
三、填充题
21.回答下列问题:
(1)氨气的红色喷泉实验说明了两点: 和 。
(2)浓硫酸加入到蔗糖,发生“黑面包”现象并产生刺激性气味的气体,体现了浓硫酸的 性和 性。
 (3)请阅读下列一段话:在一张滤纸的下方滴一滴墨水,待墨水干后,将滤纸下端边缘浸入合适的溶剂中。当溶剂沿滤纸上升时,墨水中的染料也随之上升。由于墨水中不同成分随溶剂上升的速率不同,各种染料在上升过程中逐渐分离。用这种方法可以分离微量物质。
(3)请阅读下列一段话:在一张滤纸的下方滴一滴墨水,待墨水干后,将滤纸下端边缘浸入合适的溶剂中。当溶剂沿滤纸上升时,墨水中的染料也随之上升。由于墨水中不同成分随溶剂上升的速率不同,各种染料在上升过程中逐渐分离。用这种方法可以分离微量物质。
在黄色pH试纸滴一滴新制氯水,片刻后观察到的现象如右图(白色圆斑外有一个红色的圆)。
写出相关的离子方程式: ;
请解释这一现象: 。
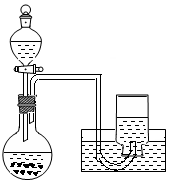
22、利用下图所示装置制备氧气并进行相关实验探究。
(1)将3.9g过氧化钠放入烧瓶中,加入100mLH2O,用排水法收集气体,过氧化钠与水反应的化学方程式是
。
(2)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色;H2O2具有氧化性和漂白性,MnO2催化条件下迅速分解。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。请通过计算对比数据加以说明上述观点是否正确。 。
②乙同学认为“红色迅速褪去”是由于溶液中存在H2O2,其来源可能是Na2O2+2H2O=2NaOH+H2O2。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
23、有一可能已变质的Na2SO3样品(无水)。某化学兴趣小组展开了对该样品分析,请你参与他们的活动。
(1)猜想样品中可能含Na2CO3、 和 (填化学式)。
(2)实验设计
①取适量样品于烧瓶中配成无色溶液,先加入过量的BaCl2溶液;
②待沉淀完全后,从分液漏斗向烧瓶中放出下列溶液 ,产生气体。
A.稀H2SO4 B. 稀HNO3 C. 稀HCl
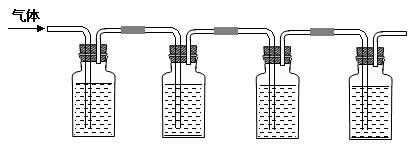 ③将气体连续通入下列装置:
③将气体连续通入下列装置:
注:上述装置中a、b、c、d分别是品红溶液、酸性高锰酸钾溶液、品红溶液、石灰水。
(3)结论:样品已部分变质。
(4)问题讨论:
i.某同学认为实验步骤①多余,你认为该步骤 (选填“是”或“不是”)多余,(若选“不是”继续回答下一空格,若选“是”不必回答下一空格),设计的用意是 。
ii. 实验步骤③中a、b、c、d的作用分别是
a b ,
c d 。
四、填充题
24、(1) 溶解金(Au)、铂(Pt)应该用 (填名称);
(2) 漂白粉的有效成分是 (填化学式);
(3) 酸雨的pH 5.6 (选填“>”、“<”或“=”);
(4) 少量钠保存在 中(选填“煤油”、“四氯化碳”或“水”);
(5) 鉴别硅酸胶体和食盐溶液的方法是 (选填“过滤”、“丁达尔现象”或“加热蒸干”)。
25、用化学方程式解释下列有关实验现象:
(1) 两只棉球分别滴有几滴浓氨水和浓盐酸放入同一只烧杯中,用表面皿盖住烧杯口,烧杯内有白烟: ;
(2) 二氧化硫使溴水褪色: ;
(3) 红棕色NO2气体溶于水产生无色气体: ;
(4) 白色胶状沉淀溶解于烧碱溶液: ;
(5) 铜粉撒入氯化铁溶液中,溶液由黄色变蓝绿色: 。
26、已知反应:6KI+8HNO3=6KNO3+3I2+2NO↑+4H2O。
(1)该反应中的还原剂是 ;
(2)该反应中,发生还原反应的过程是 → ;
(3)在反应方程式中标明电子转移的方向和数目:
6KI+8HNO3=6KNO3+3I2+2NO↑+4H2
(4)如反应中转移了0.3mol电子,则产生的气体在标准状况下体积为 。
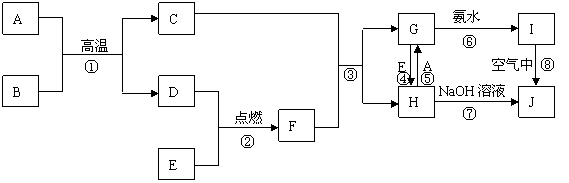
27、下列有关转化图中A是最常见的一种金属单质,B是最常见的液态物质,E是一种黄绿色气体,J是一种红褐色沉淀,除了反应①、②,其它反应在水溶液中进行,且部分反应仅标出了部分产物。
 |
回答下列问题:
(1)反应①~⑧中未涉及的反应是 ;
A.化合反应 B.分解反应 C.置换反应 D.复分解反应 E. 氧化还原反应
(2)检验H稀溶液中的阳离子所用的试剂最好是 (填化学式);
(3)写出下列化学方程式:
① ;
② ;
⑧ ;
(4)写出离子方程式
④ ;
⑥ 。
五、计算题
28、22.4g铜与一定量的浓硝酸反应,铜片完全溶解,最后得到混合气体(NO2、NO)的体积为11.2L(标准状况下测定),请回答:
(1)共消耗硝酸物质的量是 ;
(2)混合气体中各成分的物质的量分别是NO2: 、NO: 。
(3) 将该混合气体与x mol O2一起通入水中,气体完全被吸收,则x的值是 。(写出解题过程)
高一化学期末答卷
三、填充题
21、(1) 和 。
(2) 性和 性。
(3) 离子方程式: ;
解释: 。
22、(1)化学方程式是 。
(2)① ;
② 。
23、(1) 和 (填化学式)
(2) ② ;
(4)i. , ;
ii.a b ,
c d 。
四、填充题
24、(1) ;(2) ;(3) ;
(4) ;(5) 。
25、(1) ;
(2) ;
(3) ;
(4) ;
(5) 。
26、(1) ;(2) → ;
(3) 6KI+8HNO3=6KNO3+3I2+2NO↑+4H2O
(4) ;
27、(1) ;
(2) ;
(3) ① ;
② ;
⑧ ;
(4) ④ ;
⑥ 。
28、(1) (2)NO2: 、NO: ;(3)x= 。
解题过程:
2007-2008年江苏省南通第一中学第一学期
高一化学期末试题参考答案
三、填充题
21、(1) 氨极易溶于水 和 氨水呈碱性 。(每空1分)
(2) 脱水性 性和 (强)氧化性 性。(每空1分)
(3) 离子方程式: Cl2+H2O=H++Cl-+HClO ;(1分)
解释:HCl具有酸性、HClO具有漂白性、H+上升(扩散)速率大于HClO上升(扩散)速率。(3分)
22、(1)化学方程式是 2Na2O2+2H2O=4NaOH+O2↑ 。(1分)
(2)① 不正确,计算得到c(OH-)=1mol/L,在红色范围内 ;(3分)
② 溶液中加入MnO2,用带火星的木条检验产生的大量气体是氧气。(2分)
23、(1) Na2SO3 和 Na2SO4 (填化学式)
(2) ② C ;
(4)i. 不是 , 检验是否含Na2SO4 ;
ii.a 验证SO2 b 除去SO2 ,
c 验证SO2已被除尽 d 验证CO2 。(每空1分,共9分)
四、填充题
24、(1) 王水 ;(2) Ca(ClO)2 ;(3) < ;
(4) 煤油 ;(5) 丁达尔现象 。(以上每空1分共5分,)
25、(1) NH3+HCl=NH4Cl ;(以下每空1分共5分)
(2) Br2+SO2+2H2O=H2SO4+2HBr ;
(3) 3NO2+ H2O=2HNO3+NO ;
(4) Al(OH)3+NaOH=NaAlO2+2H2O 或 H2SiO3+2NaOH=Na2SiO3+2H2O ;
(5) Cu+2FeCl3=2FeCl2+CuCl2 。
![]() 26、(1) KI
;(2) HNO3 →
NO ;
26、(1) KI
;(2) HNO3 →
NO ;
(3) 6KI +8HNO3=6KNO3+3I2+2NO↑+4H2O
(4) 2.24L 。(以上每空1分,共5分)
27、(1) B ; (以下每空1分,共7分)
|
|
② H2+Cl2=2HCl ;
⑧ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;
(4)④ 2Fe2++Cl2=2Fe3++2Cl- ;
⑥ Fe2++2NH3·H2O=Fe(OH)2+2NH4+ 。
28、(1) 1.2mol(2分)、(2)NO2: 0.40mol(1分) 、NO: 0.10mol (1分);(3)x= 0.175(3分) 。
解:方法一:设与浓硝酸反应的铜物质的量为x, 与稀硝酸反应的铜物质的量为y
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
x 4x 2x y 8y/3 2y/3
![]()
![]() x+y=22.4g/64g·mol-1
x=0.20mol
x+y=22.4g/64g·mol-1
x=0.20mol
2x+2y/3=11.2L/22.4L·mol-1 y=0.15mol
(1)n(HNO3)=4x+8y/3=1.2mol (2)n(NO2)=2x=0.40mol n(NO)=0.1mol
(3) 4NO2 + O2 + 2H2O=4HNO3 4NO + 3 O2+2H2O=4HNO3
0.40mol 0.10mol 0.10mol 0.075mol
n(O2)=0.10mol+0.075mol=0.175mol 答:略。
解:方法二:n(Cu)=0.35mol n(气体)=0.5mol
Cu→Cu(NO3)2 n(HNO3)(酸)=0.35mol×2=0.70mol
HNO3(浓)→NO2 HNO3(稀)→NO n(HNO3)(氧化剂)=n(NO2)+n(NO)=0.50mol
(1)n(HNO3)(总)=n(HNO3)(酸)+n(HNO3)(氧化剂)=0.70mol+0.50mol=1.2mol
![]()
![]() (2)
n(NO2)+n(NO)=0.50mol
n(NO2)=0.40mol
(2)
n(NO2)+n(NO)=0.50mol
n(NO2)=0.40mol
n(NO2)×1+n(NO)×3=n(Cu)×2=0.70mol n(NO) =0.10mol
(3) 整个过程中相当于氧气氧化铜。
2Cu~O2 n(O2)= n(Cu)/2=0.175mol。答:略。
选择题答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | A | D | C | B | D | D | D | C | A | AB | B | AC | BC | B | B | BC | D | BD | A |