高一化学第一学期期末调查测试
化 学 试 卷
可能用到的相对原子质量:H-1 C-12 N-15 O-16 S-32 Cl-35.5
Na-23 Mg-24 Al-27 Fe-56
第Ⅰ卷(选择题共42分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.2007年3月22日是第十五届“世界水日”,3月22-28日是第二十届“中国水周”。联合国确定今年“世界水日”的宣传主题是“应对水短缺”。海水淡化是应对水短缺的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程。下列方法中可以用来进行海水淡化的是( )
A.过滤法 B.蒸馏法 C.分液法 D.蒸发法
2.下列表述不正确的是( )
A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
B.在医疗上碳酸氢钠可用于治疗胃酸过多
C.用于现代通讯的光导纤维的主要成分是高纯度的硅
D.分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液
3.下列实验操作完全正确的是( )
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的KC1溶液1000mL | 准确称取KC1固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀定容 |
| C | 除去A1C13溶液中混有的MgC12 | 向溶液中加入过量NaOH溶液,过滤后向滤液中加入适量盐酸 |
| D | 检验Fe2+的存在 | 在溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变血红色 |
| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 电解质 | 盐 | 化合物 |
| C | 胶体 | 分散系 | 混合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
4.用下图表示的一些物质或概念间的从属关系中不正确的是 ( )

5.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,22.4 L H2中所含原子数为NA
B.标准状况下,1 L水中所含分子数为![]() NA
NA
C.0.3mol /L的MgCl2溶液中含Mg2+数目0.3NA
D.常温常压下,16 g O2含有的氧原子数为NA
6.某无色溶液能溶解Al(OH)3,则此溶液中一定不能大量存在的离子组是: ( )
![]()
![]() A.
B.
A.
B.
C.![]() D.Na+、K+、SO42--、NO3--
D.Na+、K+、SO42--、NO3--
7.FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.加入KSCN溶液一定不变红色 B.溶液中一定含Fe2+
C.溶液中一定含Cu2+ D.剩余固体中一定含Cu
8.用4种溶液进行实验,下表中“操作与现象”与“溶液”不符的是 ( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入SO2,溶液不变浑浊,再加氯水变浑浊 | 可能为BaC12溶液 |
| B | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | 可能为Ca(C1O)2溶液 |
| C | 通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | 可能为Ca(OH)2溶液 |
| D | 加入BaCl2溶液,溶液中有沉淀,再滴入稀硝酸沉淀不溶解。 | 一定为含有SO42- 溶液 |
二、选择题(本题包括6小题,每小题3分,共18分。每小题有一或二个选项符合题意)
9.单质钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。以TiO2制金属钛,主要反应有:① TiO2 +2C +2Cl2![]() TiCl4+2CO;② TiCl4
+2Mg
TiCl4+2CO;② TiCl4
+2Mg![]() 2MgCl2 +Ti
2MgCl2 +Ti
下列叙述不正确的
A. 反应①中碳是还原剂 B. 反应①中TiO2是氧化剂
C. 反应②表现了金属镁还原性比金属钛强
D. 反应①氧化剂与还原剂物质的量比为1∶1
10. 下列离子方程式书写正确的是( )
A. FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B. 过量CO2通入氢氧化钠溶液中: CO2+OH-=H CO3-
C. 氯化铁溶液与铜反应:2Fe3++Cu=2Fe2++Cu2+
D. AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
11、溴化碘(IBr)的化学性质与氯气相似,能跟大多数金属反应生成金属卤化物,能跟水反应:IBr+H2O=HBr+HIO,下列有关叙述中不正确的是( )
A.IBr是双原子分子 B.在很多化学反应中IBr作氧化剂
C.IBr与水反应时,它既是氧化剂,又是还原剂
D.跟NaOH溶液反应可生成NaBr和NaIO
12.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是
A.等物质的量的浓度、等体积的(NH4)2SO4与BaCl2溶液
B. 向CuSO4溶液中加入过量NaOH溶液
C.在NaBr溶液中通入过量Cl2
D.等物质的量的NaHCO3与Na2O2固体混合物
13如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开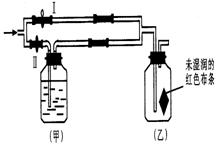 Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是
Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是
A.浓H2SO4 B.NaOH溶液 C.Ca(NO3)2溶液 D.NaCl溶液
14.某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是
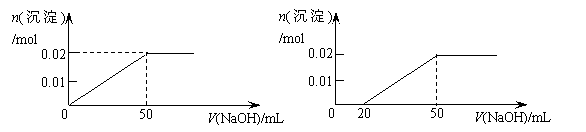
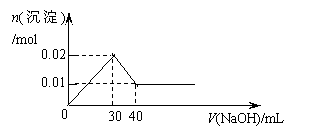
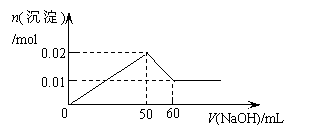 A
B
A
B
C D
第Ⅱ卷(非选择题 共58分)
三、(本题包括2小题,共16分)
 15.(8分)阅读、分析下列两个材料:
15.(8分)阅读、分析下列两个材料:
材料一 材料二
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
| 乙二醇 C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
根据上述材料及课本知识,回答下列问题(填写序号):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
⑴将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用__________。
⑵将乙二醇和丙三醇相互分离的最佳方法是__________。
⑶用CCl4提取溴水中的溴单质的最佳方法是_________.
⑷分离汽油和水的最佳方法是___________
16、(8分)某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验。
(1)用下图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
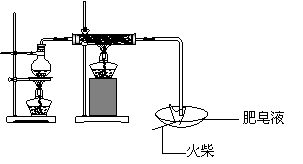
反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当 时(填实验现象),说明“铁与水蒸气”能够进行反应。
写出铁与水蒸气反应的化学方程式 。
(2)为了研究一定时间内铁粉的消耗量,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积(已折算成标准状况)
①收集并测量气体体积应选下图中的 装置
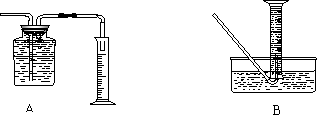 |
②称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出。最好选用 规格的量筒(选填字母序号)
A.100ml B.200ml C.500ml D.1000ml
四、(本题包括2小题,共17分)
17、(8分)某铜粉样品含少量金(Au),不含其他成分。测定该样品中金的含量时,有两种溶解样品的方法:①用稀硝酸溶解样品,②用双氧水和稀盐酸溶解样品,其反应的化学方程式为:Cu+H2O2+2HCl = CuCl2+2H2O
已知金不与稀硝酸、双氧水和盐酸反应。
(1)写出铜与稀硝酸反应的离子方程式
。
(2)在铜与双氧水、盐酸的反应中氧化剂是 ,若有2mol的H2O2参加反应,则转移电子的物质的量是 。
(3)方法①和②相比较,你认为哪种更好?理由是 。
18、(9分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的,请回答:
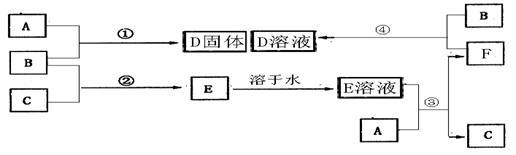
(1)反应①的化学方程式为
(2)A是 、B是 、C是 (请填化学式)
(3)反应③的离子方程式为
(4)反应④的离子方程式为
五、(本题包括2小题,共16分)
19、(10分)六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④氯水⑤Al(NO3)3⑥NaOH。
(1)某同学想不用其它试剂,仅通过颜色及用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,他能成功吗? (填“能”或“不能”)
(2)实验中发现,有两种物质的溶液在混合时,随着试剂滴加的顺序不同而出现明显不同的现象,该两种物质是 (填序号下同);有一组在混合时,随着试剂滴加后的时间不同而出现明显不同的现象,该组是 ,其中涉及氧化还原应的化学方程式为
(3)实际上实验室配制的FeSO4溶液不可长期保存,短期保存时可在FeSO4溶液配制时加入少量的硫酸防止水解,若能再加上 (填物质名称)效果会更好
20、(6分)我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析数据,回答以下问题:
①雨水样品的PH变化的原因(用化学方程式表示):
②如果将刚取样的上述雨水和自来水混和,PH将变 。(填“大”、“小”、“不变”)
(2)你认为减少酸雨产生的途径可采用的措施是
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①②⑤ D.①③⑤
六(本题包括1小题,共10分)
21.某学生用电子天平和必要的实验仪器铁铝合金中各组分的含量,其实验装置如下图所示:
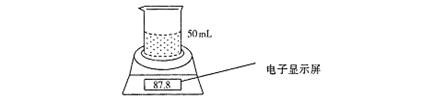
实验时,取一块铁铝合金,将其粉成碎块后全部加入到盛有50 mL,5 mol·L-1 NaOH溶液的烧杯中。试回答下列问题:
(1)合金表面产生气泡的反应的离子方程式为: 。
(2)不同时间电子天平的示数如下表所示:
| 实验操作过程 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 80.0 | |
| 烧杯+溶液+样品 | 0 | 87.8 |
| 1 | 87.5 | |
| 2 | 87.3 | |
| 3 | 87.2 | |
| 4 | 87.2 |
则合金中铁的质量分数为 (保留三位有效数字,下同)
(3)上述50 mL NaOH溶液中最多可加入的铁铝合金样品质量为多少?
高一期末调查测试化学试卷答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | D | D | B | D | B | C | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 |
|
|
| 答案 | B | BC | C | AC | AB | C |
|
|
15、C、A、B、D(每空2分)
16、(1)肥皂泡破裂,有爆鸣声。(2分)3Fe + 4H2O Fe3O4 + 4H2↑(2分)
(2) ①B (2分)②B(2分)
17(1)3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O (2分)
(2)双氧水(2分),4mol (2 分)
(3)方法②更好,因为产物中没有污染空气的有害气体。) (2分)
18、(1)2Fe+3Cl2===2FeCl3 (2分) (2)Fe Cl2 H2(每空1分)
(3)2H++ Fe=== Fe2+ +H2 ↑ (4) 2Fe2++ Cl2==2Fe3++ 2Cl-
19、(1)能(2分) (2)⑤⑥(2分)①⑥(2分)4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(3)铁(2分)
20、①2H2SO3+O2=2H2SO4 ②小; (2)D.(每空2分)
21、((10)(1)2Al+2OH-+2H2O=2AlO2-+3H2 ↑ (2分) (2)30.8% (3分)
(3)9.75g (4分)