高一化学第一学期期末调研考试试题
高 一 化 学
说明:
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题),共6页五个大题23个小题。第Ⅰ卷1-2页,第Ⅱ卷3-6页。满分100分,考试时间90分钟。
2. 第Ⅰ卷答案填写在第Ⅱ卷卷首的Ⅰ卷答案栏内,第Ⅱ卷答案直接写在试卷上。
3. 答题前请将密封线内的项目填写清楚。
相对原子质量:H.1 C.12 O.16 Na.23 Cl.35.5
第I卷(选择题 共48分)
一、 选择题(本题包括16个小题,每小题只有一个选项符合题意。每小题3分,共 48分)
|
A.2FeCl3+Cu=2FeCl2+CuCl2 B.Cu2(OH)2CO3
C.4Fe(OH)2+2H2O+O2=4Fe(OH)3 D.CaCO3+2HCl=CaCl2+H2O+CO2↑
2.做溶液的导电性实验时,如果在下列各100mL溶液中加入少量的氢氧化钠固体,溶液的导电性变化最不明显的是
A.蒸馏水 B.NaCl溶液 C.盐酸 D.Na2CO3溶液
3.可以用离子方程式H++OH-=H2O来表示的化学反应是
A.硫酸与氢氧化铜反应 B.硫酸溶液与氢氧化钡溶液反应
C.硝酸与烧碱溶液反应 D.次氯酸溶液与烧碱溶液反应
4.在配制一定物质的量浓度的NaOH溶液时,下列因素会造成所配溶液浓度偏高的是B
A.所用NaOH已经潮解 B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里 D.称量时误用“左码右物”
5.下列说法正确的是A
A.电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离
B.强电解质与弱电解质的本质区别,是其水溶液导电性的强弱
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.常见的强酸、强碱和大部分盐都是强电解质,其他化合物都是弱电解质
6.下列离子方程式正确的是
A.铁与稀硫酸反应: 2Fe +6H+ =2Fe3+ +3H2↑
B.氧化铜与硝酸(aq)反应: O2- + 2H+ = H2O
C.氢氧化镁溶于盐酸: Mg(OH)2 +2H+ =Mg2+ +2H2O
D.钠放于水中: Na+H2O =Na++OH-+H2↑
7.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是B
A.不溶于水,且必须易与碘发生化学反应 B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大 D.不溶于水,且必须比水密度小
8.下列反应不属于氧化还原反应的是
A.石灰石固体煅烧 B.氯气通入氢氧化钠溶液中
C.氢气和氧气混合点燃 D.氢气通入盛灼热氧化铜的试管
9.下列物质中属于电解质的是
① KOH ② CuSO4 ③ Al ④HCl ⑤ 蔗糖
A.①② ③ B.②③④ C.③④ D.①②④
10.向含有下列离子的溶液中加入一小块金属钠,引起该离子数目减少的是
![]() A. CO32- B.Cl- C.OH- D.HCO3-
A. CO32- B.Cl- C.OH- D.HCO3-
11.实验室制Cl2的反应为4HCl(浓)十Mn02 MnCl2+C12↑+2H2O.下列说法错误的是
A.还原剂是HCl,氧化剂是Mn02
B.每生成1 molCl2,转移电子的物质的量为2 mol
C.每消耗1 molMnO2,被氧化的的HCl为4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
12.如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是
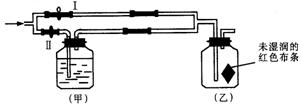
A.浓H2SO4 B.NaOH溶液 C.Ca(OH)2溶液 D.NaCl溶液
13.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.32g氧气所含原子数目为2NA B.在标准状况下,22.4L水所含的的分子数目为NA
C.11.2L氯气含有的分子数为0.5NA D.氯化氢的摩尔质量为36.5g
14.标准状况下两个容积相等的贮气瓶,一个装有02,另一个装有CH4和O2,两瓶气体具有相同的
A.质量 B.原子总数 C.密度 D.分子数
15.x gNa2O和y gNa2O2分别加入等质量的水中(水足量),结果得到等质量分数的溶液,则x与y关系正确的是
A.x = y B.x > y C.x < y D.无法确定
16.用10 mL 0.1 mol·L-1 的BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.3∶2∶2 B.1∶2∶3 C.1∶3∶3 D.3∶1∶1
平顶山市2007~2008学年第一学期期末调研考试
| 座号 |
|
高 一 化 学
说明:1.答题前请将密封线内各项内容填写清楚。
2.考试结束后,只把Ⅱ卷交回。
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 分数 |
I卷答案栏:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
| |||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
第Ⅱ卷 (非选择题,共52分)
二、本题包括2个小题,共12分。
17.(8分)为了研究金属钠的性质,某同学做了如下实验,请你填写相关空白:取出一盛放钠的试剂瓶,观察到钠是保存在_________中,用镊子夹取一块钠,在空气中切开,可看到断面呈________色,具有_________,但断面很快变_________,主要由于生成了一薄层___________;若把钠放在坩埚上加热可观察到_____________________________,反应的化学方程式是___________________________________。
18.(4分)从金属锌、氢气、氧气、水、一氧化碳、氧化铜、盐酸中任意挑选作为反应物,按下列要求写出一个化学反应方程式:
①既属于化合反应,又属于氧化还原反应:
②属于氧化还原反应,不属于置换反应、化合反应、分解反应、复分解反应:
三、本题包括2个小题,共14分。
19.(5分)前一段时间,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。发生反应的离子方程式是:ClO-+Cl-+2H+=Cl2↑+H2O。根据你所掌握的化学知识作出如下判断:当事人使用的液态洁污剂之一必定含氯,其中氯最可能的存在形式是 和 (填离子),当另一种具有 (性质)的液态洁污剂与之混合,可能发生上述反应而产生氯气。举例说明这两种洁污剂的名称(家用洁污剂的商品名称) 、 。
20.(9分)现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
|
|
|
| |
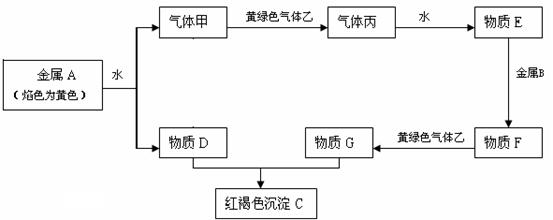
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙 、丙 、 F 、
(2)写出下列反应的化学方程式或离子方程式:
①金属A和水反应的离子方程式
②物质E和金属B反应的离子方程式
③物质D和G反应的化学方程式
四、本题包括2个小题,共16分。
21.(5分)
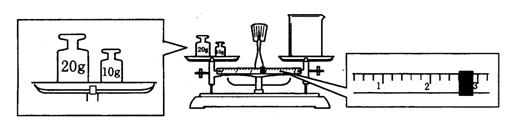
(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为______________g.
(3)指出下面3个实验中各存在的一个错误:
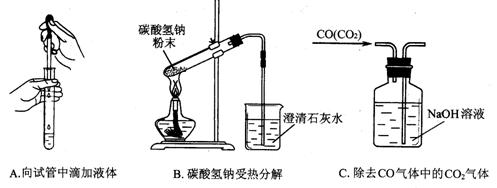
A______________________,B__________________________,C____________________
22.(11分)
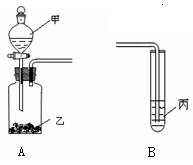 某化学兴趣小组的同学利用下列实验装置进行物质的制备、性质等实验。请按要求填空。
某化学兴趣小组的同学利用下列实验装置进行物质的制备、性质等实验。请按要求填空。
(1)利用A装置可制取的气体单质有(写出两种即可)_________________。
(2)A、B装置相连后可完成多种实验:
① 若在甲、乙、丙中盛装的试剂分别为:稀盐酸、石灰石、次氯酸钙溶液,则实验开始后在试管丙中可观察到的现象为____________________,该实验可说明相关酸的酸性的强弱顺序是__________________________________________。
②已知KMnO4在常温下可与浓HCl反应生成Cl2,反应方程式为:2KMnO4+14HCl== 2MnCl2+5Cl2↑+7H2O,欲利用该装置设计一个简单的实验验证KMnO4、Cl2、Br2的氧化性强弱,则甲、乙、丙中分别盛装的试剂是:甲____________、乙________、丙_____________;乙、丙中可观察到的现象是:乙中 、
丙中 ;由此得出的结论是 。
五、本题包括1个小题,共10分。
23.(10分) 在200 mL 1 mol·L-1的NaHCO3溶液中,加入一定质量单质或化合物X,恰好将其转化为只含Na2CO3溶质的溶液。
(1)该过程中一定发生的一步反应的离子方程式为_____________________________
(2)能实现上述转变的物质X有多种,请在下表中尽可能多地填写符合条件的X的化学式及其质量:(如空格不够可另加)
| 编号 | 1 | 2 | 3 | 4 | 5 | |
| X的化学式 | ||||||
| 加入X的质量/g |
高一化学第一学期期末调研考试试题
高一化学参考答案及评分意见
说明:考生给出其他合理答案可比照给分。
I卷答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | C | C | B | A | C | B | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | D | C | A | A | D | C | C |
第Ⅱ卷 (非选择题,共52分)
二、本题包括2个小题,共12分。
![]() 17.(8分)煤油; 银白色; 金属光泽; 暗; 氧化钠; 钠熔化成小球,并迅速燃烧起来,火焰为黄色,生成淡黄色粉末;(各1分)2Na +
O2 Na2O2 (2分)
17.(8分)煤油; 银白色; 金属光泽; 暗; 氧化钠; 钠熔化成小球,并迅速燃烧起来,火焰为黄色,生成淡黄色粉末;(各1分)2Na +
O2 Na2O2 (2分)
18.(4分)2H2+O2=2H2O或2Zn+O2=2ZnO或2CO+O2=2CO2
![]()
②CO+CuO Cu+CO2 (每个方程式2分,共4分)
三、本题包括2个小题,共14分。
19.(5分)(每空1分)
ClO-和Cl-; 酸性;84(或者是“漂白液”、“漂白粉”等)、洁厕净(主要成分是盐酸)
20.(9分)(1)乙:Cl2 丙:HCl F:FeCl2 (各1分,共3分)
(2)①2Na + 2H2O == 2OH -+ H2↑ (2分)
②Fe + 2H+ == Fe2+ + H2↑ (2分)
③FeCl3+ 3NaOH == Fe(OH)3↓+ 3NaCl (2分)
四、本题包括2个小题,共16分。
21.(5分)
(1)砝码放在左盘,烧杯放在右盘(或砝码和物品的位置放反了)(1分) 27.4g(1分)
(3)A.滴管口伸人试管中 B.试管口向上 C.混合气体从短导管进入洗气瓶(各1分 )
22.(11分)
(1)H2、O2等 (1分)
(2)①溶液变浑浊(或溶液先变浑浊后又变澄清) (1分)
盐酸的酸性比碳酸强,碳酸的酸性比次氯酸强 (2分)
②甲、浓盐酸 乙、高锰酸钾 丙、溴化钠溶液,(各1分)
乙中有黄绿色气体生成,丙中液体由无色变为橙色(各1分)
氧化性的强弱为:KMnO4>Cl2>Br2 (2分)
五、本题包括1个小题,共10分。
23.(10分)
(1)HCO3-+OH-![]() CO32-+H2O (2分)
CO32-+H2O (2分)
(2)
| 编号 | 1 | 2 | 3 | 4 | ||
| X的化学式 | Na | NaH | Na2O | Na2O2 | NaOH | |
| 加入X的质量/g | 4.6 | 4.8 | 6.2 | 7.8 | 8.0 |
(每组2分)只要求答对4组