高一化学物质结构元素周期律测试题(B卷)
广州市高一化学中心组提供 2008.3
本试卷分第一部分(选择题)和第二部分(非选择题),满分100分,测试时间40分钟。
第一部分 选择题(共56分)
一、选择题(本题包括14小题,每小题4分,共56分。每小题只有1个选项符合题意。)
1.![]() C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关
C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关![]() C的说法正确的是
C的说法正确的是
A.质子数为6 B.电子数为13
C.中子数为6 D.质量数为6
2.下列各组的三种元素,属于同一周期的是
A.C、H、O B.Li、Na、K
C.Si、P、S D.F、Cl、Br
3.某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为
A.HX B.H2X C.XH3 D.XH4
4.下列关于氯、溴两种元素及其组成的物质的比较中,不正确的是
A.稳定性:HCl<HBr B.非金属性:Cl>Br
C.酸性:HClO4>HBrO4 D.氧化性:Cl2>Br2
5.下列物质中,只含非极性共价键的是
A.NaOH B.H2 C.H2S D.NaCl
6. 下列各图为元素周期表的一部分,表中的数字为原子序数,其中M的原子序数为37的是
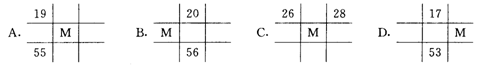
7. 已知X为ⅠA族元素,Y为ⅦA族元素,则X与Y形成的化合物中相邻原子间存在的相互作用是
A.离子键 B.极性共价键
C.非极性共价键 D.范德华力
8. 某元素的原子序数为7,下列有关该元素的推断不正确的是
A.它处在元素周期表中第二周期ⅤA族
B.它的最高正价为+5,负价为-3
C.它的最高价氧化物对应水化物是一种强酸
D.它的非金属性比磷弱比氧强
9.下列各组元素性质或原子结构的递变,叙述不正确的是
A.Na、Mg、Al原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次增大
C.Li、Na、K的电子层数依次增多
D.N、O、F得电子能力依次减弱
10. 元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A.左、下方区域的金属元素 B.右、上方区域的非金属元素
C.金属元素和非金属元素分界线附近的元素 D.稀有气体元素
11. 同周期的X、Y、Z三元素,其最高价氧化物对应水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是
A.原子半径:X>Y>Z
B.非金属性:X>Y>Z
C.阴离子的还原性按X、Y、Z的顺序由强到弱
D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强
12. 甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
A.x+4 B.x+8 C.x+16 D.x+18
13. 下列关于铷(Rb)的叙述正确的是
A.它位于周期表的第四周期、第ⅠA族
B.在钠、钾、铷3种单质中,铷的熔点最高
C.氢氧化铷是弱碱
D.硝酸铷是离子化合物
| A | ||
| B | C |
14.短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,
则A、B、C依次是
A.Be、Na、Al B.C、Al、P
C.O、P、Cl D.B、Mg、Si
高一 班 姓名 学号 成绩
第二部分 非选择题(共44分)
二、非选择题(共44分)
15.(16分)下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ;
(4)在B、C、D、E、F、G、H中,原子半径最大的是 .
16.(14分)甲、乙、丙、丁是四种短周期元素,乙原子有三个电子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲是 元素(填元素符号),甲的单质与水反应的化学方程式为
;
(2)乙是 元素(填元素符号),原子结构示意图为 ;
(3)丙是 元素(填元素名称),最高价氧化物对应水化物的化学式是 ;
(4)丁是 元素(填元素名称),甲与丁两种元素可组成的物质有 、
。(填化学式)
17.(14分)A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素的最高价氧化物的水化物之间的相互反应的化学方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
。
人教版必修2第一章《物质结构 元素周期表》测试题(B卷)
参考答案
一、选择题(本题包括14小题,每小题4分,共56分。每小题只有1个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | A | C | B | A | B | B | A |
| 题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | D | D | C | B | A | D | C |
二、非选择题(共44分)
15.(16分)
(1)Ne、F、F2、Na (每空1分,共4分)
(2)NaOH、HClO4、Al(OH)3 (每空2分,共6分)
(3)HF (3分)
(4)Na (3分)
16.(14分)
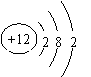 (1)Na(1分) 2Na+2H2O=2NaOH+H2↑ (2分)
(1)Na(1分) 2Na+2H2O=2NaOH+H2↑ (2分)
(2)Mg (1分) (2分)
(3)碳 (1分) H2CO3 (2分)
(4)氧 (1分) Na2O (2分),Na2O2 (2分)
17.(14分)
(1)A:Na, B:Al, C:Si, D:P, E:S (每空1分,共5分)
![]() (2)
(2)
(3分)
(3)Al(OH)3+ NaOH === NaAlO2+2H2O (3分)
(4)H3PO4>H2SiO3 (3分)
