高一化学竞赛训练题
一、选择题
1.下列物质属于电解质的是( )
①NaOH ②蔗糖 ③Na2CO3 ④Cu ⑤酒精
A.①②③ B.①③ C.②④ D.④
2.下列反应中,水只作还原剂的是( )
A.CaO+H2O=Ca(OH)2
B.C+H2O CO+H2
CO+H2
C.2F2+2H2O=4HF+O2↑ D.3NO2+H2O=2HNO3+NO
3.下列实验操作正确的是( )
A.使用容量瓶配制溶液,移液时应洗涤烧杯2~3次.
B.用100ml量筒量取2.50ml稀盐酸
C.用托盘天平称量25.20gNaCl固体
D.使用滴定管前,只用水润洗滴定管
4.在3Cl2+6NaOH![]() NaClO3+5NaCl+3H2O的反应中,下列说法正确的是.( )
NaClO3+5NaCl+3H2O的反应中,下列说法正确的是.( )
A.NaCl是氧化产物,NaClO3是还原产物
B.被氧化的氯原子与被还原的氯原子物质的量之比为1∶5
C.Cl2既是氯化剂又是还原剂
D.氧化剂得电子数与还原剂失电子数之比为1∶5
5.下列反应的离子方程式错误的是( )
A.小苏打与盐酸反应HCO3-+H+![]() CO2↑+H2O
CO2↑+H2O
B.碳酸氢钙与足量氢氧化钠溶液反应
Ca2++2HCO3-+OH-![]() CaCO3↓+H2O+HCO3-
CaCO3↓+H2O+HCO3-
C.钾与水反应K+2H2O![]() K++2OH-+H2↑
K++2OH-+H2↑
D.氢氧化钠与三氯化铁溶液反应
Fe3++3OH-![]() Fe(OH)3↓
Fe(OH)3↓
6.下列溶液中溶质质量分数最大的是( )
A.4.6g钠投入45.4g水中 B.6.2gNa2O投入43.8g水中
C.7.8gNa2O2投入42.2g水中 D.8gNaOH投入42g水中
7.下列物质的溶液,能和小苏打反应,且既无气体也无沉淀产生的是( )
A.苏打 B.盐酸 C.熟石灰 D.烧碱
8.在天平两边各放一个相同质量的烧杯,分别加入100gH2O,向左盘烧杯中加入4.6g金属钠,为了保持天平指针指向零点,应向右盘加入金属钾的质量为( )
A.3.90g B.4.52g C.5.12g D.7.80g
9.下列说法不正确的是( )
①除去CO中混有的CO2,可让气体通过Na2O2粉末②不慎将浓NaOH液沾在皮肤上,应立即用H2SO4溶液冲洗③碱金属在氧气中燃烧,都得到R2O2④做焰色反应实验时所用铂丝,每次用完后用稀硫酸洗涤后再使用
A.只有① B.只有②③
C.只有①③ D.①②③④
10.将下列各组溶液进行混合,有白色沉淀生成,加入过量稀硝酸,沉淀消失并放出气体,再加AgNO3溶液又生成白色沉淀,则该组溶液是( )
A.Na2CO3和MgBr2 B.Ba(OH)2和K2SO4
C.Ba(OH)2和(NH4)2SO4 D.Na2CO3和CaCl2
11.根据下列反应:W![]() X+CO2↑+H2O、Z+CO2→X+O2↑、Z+H2O→Y+O2↑,判断W、X、Y、Z应分别依次是( )
X+CO2↑+H2O、Z+CO2→X+O2↑、Z+H2O→Y+O2↑,判断W、X、Y、Z应分别依次是( )
A.Na2CO3、NaHCO3、NaOH、Na2O2
B.KHCO3、K2CO3、KOH、K2O2
C.Ca(HCO3)2、Na2CO3、NaOH、Na2O2
D.Ca(HCO3)2、CaCO3、Ca(OH)2、CaO
12.将10LCO2和水蒸气的混合气体通过Na2O2,结果气体体积变成6L(均为标准状况下的体积),则参加反应的Na2O2的质量为( )
A.48.6g B.27.9g C.12g D.无法确定
13.关于同温、同压下等体积的CO2和CO的叙述;①质量相等;②密度相等;③所含分子个数相等;④所含碳原子个数相等,其中正确的是( )
A.①②③④ B.②③④ C.只有③④ D.只有③
14.某学生用量筒量取液体,量筒放平稳且面向刻度线,初次仰视液面,读数为19mL,倾倒出部分液体后,俯视液面,读数是11mL,则实际上倾倒出液体的体积是( )
A.8mL B.大于8mL C.小于8mL D.无法判断
15、可以证明某化合物内一定存在离子键的性质是( )
A.易溶于水 B.具有较高的熔点
C.熔融状态能导电 D.溶解于水能电离
16.将溶质质量分数为a%,物质的量浓度c1mol/L的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数为2a%,此时物质的量浓度为c2mol/L.则c1和c2的关系是( )
A.c2=2c1 B.c2<2c1 C.c2>2c1 D.c1=2c2
17.由CO2、H2和CO组成的混合气在同温、同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比为( )
A.29∶8∶13 B.22∶1∶14
C.13∶8∶29 D.26∶16∶57
18.已知某饱和溶液的:①溶液的质量;②溶剂质量;③溶液体积;④溶质的摩尔质量;⑤溶质的溶解度;⑥浓液的密度.从以上条件组合中,不能用来计算该饱和溶液的物质的量浓度的是( )
A.①③④ B.④⑤⑥ C.①②③④ D.①③④⑤
19.下列试剂保存方法正确的是( )
A.金属钠放入四氧化碳中 B.液溴表面加水进行水封
C.溴化银放入无色玻璃中 D.把潮湿的氯气贮存在钢瓶中
20.用30.1g卤化钾跟足量AgNO3溶液发生反应,生成42.6g沉淀,则该卤化钾的化学式是( )
A.KCl B.KF C.KBr D.KI
21.漂白粉的氧化性远不如次氯酸,为何工业上用的漂白剂常用漂白粉而不用次氯酸,主要原因是( )
A.漂白粉比次氯酸经济 B.漂白粉较次氯酸稳定,易运输和保存
C.漂白粉漂白能力强于次氯酸 D.漂白粉较次氯酸易于制备
22.某元素原子的最外层只有2个电子,则该元素 ( )
A.一定是ⅡA族元素 B.—定是金属元素
C.一定是正二价元素 D.可能是金属元素,也可能不是金属元素
23.不同卤原子间可以共用电子对形成卤素互化物,其通式为XX′n(n=1,3,5,7).这种互化物绝大多数不稳定,易发生水解反应.已知BrFn和水反应时物质的量之比为3∶5,生成溴酸、氢氟酸、溴单质和氧气.试判断下列叙述正确的是( )
A.此卤素互化物的分子式为BrF3
B.此卤素互化物的分子式为BrF5
C.BrFn的性质类似卤素单质,有强还原性
D.每摩BrFn完全反应,可生成等物质的量的Br2和O2
24.VmL1mol·L-1AgNO3溶液恰好与同体积的下列溶液完全反应,这些溶液中物质的量浓度最大的是( )
A.KCl溶液 B.MgCl2溶液 C.BaCl2溶液 D.AlCl3溶液二、填空题
1.下面a~e是中学生实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是______.(填写编号)
(2)能够用以精确量取液体体积的是______.(填写编号)
(3)在读取a、b仪器内液体的体积数时,俯视得到的数据比正确数据偏小的是______.(填写编号)
(4)移取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为______g.
2.现有KHCO3和CaCO3的混合物与之等质量的NaHCO3,分别与等质量分数的盐酸反应,消耗酸的质量相同,则混合物中KHCO3与CaCO3的质量比为_____________。
3.将金属钾投入CuSO4溶液中,有时会看到黑色沉淀现象,试用化学方程式及必要的文字说明原因:____________________________________________
___________________________________________________________。
4.有一种白色粉末装物质A,将其分为质量相等的两份:取其中一份加热分解得到能使澄清石灰水变浑浊的气体B和残余物C,用另一份加入足量盐酸,也会产生气体B,但产生气体的量是上述的两倍,气体B跟一种淡黄色粉末状物质D反应,产生无色无臭的气体单质E,同时又得到C,再取少量A进行焰色反应,火焰呈黄色,则各物质的化学式为:A_____________;B_____________;C_____________;D_____________;E_____________;有关反应的化学方程式为:①_______________________________;②_______________________________;③_____________________________;④_________________________________________
5.Cl2在70°的NaOH溶液中,能同时发生两个自身氧化还原反应,反应的化学方程式为:
(1)_____________________________________;
(2)_____________________________________;
反应完全后测得溶液中NaClO和NaClO3的数目之比为4∶1,则溶液中NaCl和NaClO的物质的量之比为_________.
6、正长石的化学式为KAlSi3Ox,其中x的值为 。滑石的化学式为Mg3(Si4O10)(OH)2把它改写成氧化物的形式为 ____________________
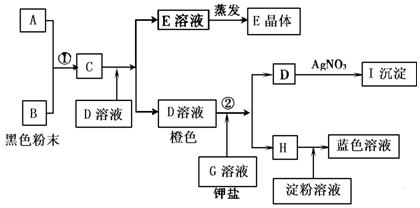 |
三、推断题
根据上图转化关系回答下列问题
(1)写出①的离子反应方程式:_________________________;写出②的离子反应方程式:_________________________.
(2)推出下列物质或溶液中溶质的化学式.E____________,I_____________.
(3)在上述转化过程中,判断B、C、F、H氧化能力由弱到强的顺序(写化学式):________
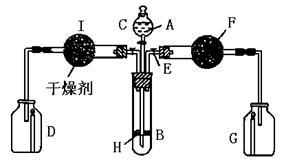
四、实验题
1.为证明有关物质的性质,某学生设计了下图所示装置。当打开活塞C,使液体A与搁板H上的块状固体B相遇时,即有气体产生,并发现D中蜡烛慢慢熄灭;关闭C打开E时,则看到G中蜡烛燃得更亮。
(1)请写出装置中有关仪器内盛放的物质:A_____________,B_____________,F_____________;
(2)用化学方程式表示上述实验中发生的有关反应_________________________;_________________________;_________________________。
 |
2..向滴有酚酞的NaOH溶液中通入SO2气体,当通入一定量时,发现溶液的红色褪去,同学们在讨论时对产生这一现象的原因提出了两种观点:
① SO2与酚酞结合生成了无色的新物质,即酚酞被漂白了。
② SO2与NaOH反应,使溶液不再呈碱性,所以酚酞的红色褪去。
请你设计一个简单的实验来验证酚酞褪色的原因,简述所用的试剂、操作、可能产生的现象和结论。
五、计算题(16′)
1.在100℃时,3.88g气体X与足量的Na2O2充分反应,放出一定量的O2,且固体质量增加了2.28g。求:(1)X是何种气体? (2)其质量是多少?
2、已知硫化氢是一种可燃性气体, 在氧气充足和氧气不足的情况下分别能完全燃烧和不完全燃烧,方程式如下:
![]() 2H2S
+3O2
2H2O + SO2 (完全燃烧)
2H2S
+3O2
2H2O + SO2 (完全燃烧)
![]() 2H2S
+ O2 2H2O
+2S (不完全燃烧)
2H2S
+ O2 2H2O
+2S (不完全燃烧)
若将a mol H2S 和一定物质的量(用x表示)的O2 充入一容器中用电火花点燃使其反应,反应后的容器保持120 0C 、101kPa。请回答:
(1) 若氧化产物全部是硫,则x的取值范围是________________
(2) 若氧化产物全部是二氧化硫,则x的取值范围是________________
(3) 若氧化产物部分是硫,部分是二氧化硫, 则x的取值范围是________________
这时, 反应所生成的二氧化硫的物质的量是__________ mol,
容器内气体的物质的量之和是 _________ mol
高一化学综合测试题参考答案
一、1.B 2.D 3.C 4.A 5.C 6.CD 7.C 8.BD 9.BC 10.BD 11.C 12.B 13.C 14.D 15.B 16.D 17.D 18.B 19.B 20.D 21.C 22.C 23.B 24.A 25.C 26.CD 27.A 28.C 29.B 30.D 21.B 32.A 33.D 34.D 35.B 36.A 37.B 38.AD 39.D 40.A
二、1.(1)abc (2)c (3)b (4)9.5
2.(1)置换反应;化合反应 (2)H2+CuO![]() Cu+H2O;C+H2O
Cu+H2O;C+H2O![]() CO+H2;Fe+2H+=Fe2++H2↑;Fe+Cu2+=Fe2++Cu
3.(1)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O (2)HNO3、Cu(NO3)2、
CO+H2;Fe+2H+=Fe2++H2↑;Fe+Cu2+=Fe2++Cu
3.(1)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O (2)HNO3、Cu(NO3)2、![]() 4.锂;铯;铯 5.即钾成小球浮于液面上,迅速向各个方向游动,溶液中出现蓝色沉淀;2K+2H2O=2KOH+H2↑ 2KOH+CuCl=2KCl+Cu(OH)2↓ 6.2Na2O2+2CO2=2Na2CO3+O2 Na2O2 供氧剂 7.Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 8.①2Na+2HCO3-=2Na+2CO32-+H2↑ ②2Na+2H2O+Cu2+=Cu(OH)2↓+2Na+H2↑ ③2K2O2+2CO2=2K2CO3+O2↑ ④Ba2++2OH-+2NH4++SO42-
4.锂;铯;铯 5.即钾成小球浮于液面上,迅速向各个方向游动,溶液中出现蓝色沉淀;2K+2H2O=2KOH+H2↑ 2KOH+CuCl=2KCl+Cu(OH)2↓ 6.2Na2O2+2CO2=2Na2CO3+O2 Na2O2 供氧剂 7.Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 8.①2Na+2HCO3-=2Na+2CO32-+H2↑ ②2Na+2H2O+Cu2+=Cu(OH)2↓+2Na+H2↑ ③2K2O2+2CO2=2K2CO3+O2↑ ④Ba2++2OH-+2NH4++SO42-![]() BaSO4↓+2NH3↑+2H2O 9.4∶17 10.2K+2H2O+CuSO4=Cu(OH)2↓+K2SO4+H2↑ 该反应放热,促使Cu(OH)2
BaSO4↓+2NH3↑+2H2O 9.4∶17 10.2K+2H2O+CuSO4=Cu(OH)2↓+K2SO4+H2↑ 该反应放热,促使Cu(OH)2![]() CuO+H2O 11.A:NaHCO3 B:CO2 C:Na2CO3 D:Na2O2 E:O2 ①2NaHCO3
CuO+H2O 11.A:NaHCO3 B:CO2 C:Na2CO3 D:Na2O2 E:O2 ①2NaHCO3![]() Na2CO3+CO2↑+H2O ②CO2+Ca(OH)2=CaCO3↓+H2O ③NaHCO3+HCl=NaCl+H2O+CO2↑ ④2Na2O2+2CO2=2Na2CO3+O212.(1)CO (2)Cl2 (3)O2、H2、CO (4)Cl2 (5)O2、Cl2、H2、CO (6)Cl2、HF、HCl、HB、HI、CO2 (7)Cl2、HCl、HBr、HI (8)H2、CO
Na2CO3+CO2↑+H2O ②CO2+Ca(OH)2=CaCO3↓+H2O ③NaHCO3+HCl=NaCl+H2O+CO2↑ ④2Na2O2+2CO2=2Na2CO3+O212.(1)CO (2)Cl2 (3)O2、H2、CO (4)Cl2 (5)O2、Cl2、H2、CO (6)Cl2、HF、HCl、HB、HI、CO2 (7)Cl2、HCl、HBr、HI (8)H2、CO
13.(1)Cl2+2NaOH=NaCl+NaClO+H2O
(2)3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
9∶4
14.adeh;h;氨气是碱性气体,不能被碱石灰吸水
15.(1)洗气瓶,水,吸水 (2)燃烧管、酒精灯、导气管、气体吸水装置(图略)、桔黄色物质出现 (3)Cl2+2NaOH=NaCl+NaClO+H2O
三、(1)①MnO2+2Cl-+4H+=Mn2++Cl2↑+2H2O
②Br2+2I-=2Br-+I2
(2)EKCl;IAgBr E:KCl,I:AgBr
(3)I2<Br2<Cl2<MnO2
四、1.解析:该装置的左半部的现象和反应实际上是提示:A与B反应产生的气体是不助然的,是CO2,由此可知A是稀盐酸,B可选用块状大理石(CaCO3).从装置右边的实验现象可判断,未经干燥的CO2和F发生反应,产生一种助燃的气体,即氧气,则F可能是Na2O2,产物和反应物确定后,写出有关反应方程式就不难了.
答案:稀盐酸,CaCO3,Na2O2;CaCO3+2HCl=CaCl2+H2O+CO2↑
2Na2O2+2CO2=2Na2CO3+O2↑
2Na2O2+2H2O=4NaOH+O2↑
2.解析:
K+ KCl
(0.17×2+0.16)mol 0.5mol
∴所需KCl的质量为:0.5×74.5=37.3(g)
SO42- ~ Na2SO4 ~ 2Na+
0.17 0.17 0.34
∴需Na2SO4的质量为:0.17×142=24.1(g).
需NaCl的质量为:(0.5-0.17×2)×58.5=9.4(g).
用天平称取37.3gKCl、24.1gNa2SO4、9.4gNaCl放入一个烧杯中,加入适量蒸馏水,搅拌,使之全部溶解,转移到1L溶量瓶中,用蒸馏水洗涤烧杯两次.把洗涤液都注入容量瓶里,然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度2cm~3cm处,改用胶头滴管加水到瓶颈刻度处,使溶液的凹面正好跟刻度相平,塞上塞子,摇匀.
五、1.(1)![]()
(2)NO:9g NH3:11.9g
2.82.6%
3.(1)气体x为CO2与水蒸气的混合气体
(2)CO2:3.52g H2O:0.36g
4.8.4g