高一化学竞赛试题
2008.4
第Ⅰ卷(共48分)
可能用到的相对原子质量: O-16 S-32 Cu-64 N-14 Zn-65 H-1
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1. 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含的中子数为8 B.NH3的结构式为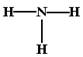
C.HCl的电子式为![]() D.热稳定性:H2S>HF
D.热稳定性:H2S>HF
2.目前,科学家拟合成一种“二重构造”的球形分子,即把足球型的C60分子熔进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合。下列说法正确的是
A、它是由两种单质组成的混合物 B、它是一种硅酸盐
C、它是一种新型化合物 D、它是一种合金
3.氢化钙可作生氢剂,反应方程式为CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.溶剂 B.还原剂 C.氧化剂 D.既作还原剂又氧化剂
4.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是
A.NH4+、Fe2+、CO32-、SO42- B.Na+、K+、Cl-、SO42-
C.Mg2+、H+、Cl-、NO3- D.K+、Ca2+、HCO3-、Cl-
5. 已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O====2Fe2++SO![]() +4H+
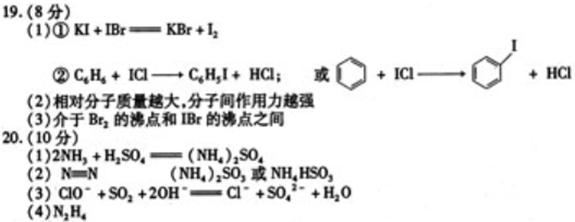
+4H+
B.2Fe2++Cl2====2Fe3++2Cl-
C.I2+SO2+2H2O====H2SO4+2HI
D.H2O2+H2SO4====SO2+O2+2H2O
6.2004年4月15日重庆发生的氯气泄漏事故、2004年4月20日江苏扬州发生的氨气泄漏事故再一次给安全生产敲响了警钟。下列有关氯气和氨气的说法中正确的是
A.氯气和氨气都是易液化的气体
B.氯气和氨气都是无色、密度比空气大的有毒气体
C.氯气和氨气都是由极性键构成的分子
D.氯气和氨气分子中所有原子都满足最外层为8电子结构
7.短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素原子次外层电子数等于其原子核外电子总数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是
A、 C>D>B>A B、 D>B>A>C C、 A>D>C>B D、 B>A>C>D
8.某晶体水溶液中加入Fe2+的溶液,再加稀HNO3溶液立即变红,另取该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是
A.KSCN B. NH4SCN C. NH4Cl D. FeCl3
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。 若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
9.下列对气体体积的叙述中正确的是
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也一定不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
10.下列反应的离子方程式书写不正确的是
A、在氢氧化钙溶液中加入过量小苏打:Ca2++OH-+HCO-3 = CaCO3↓+H2O
B、在氢氧化钾稀溶液中通过量的二氧化硫气体:SO2+OH- = HSO-3
C、过量的铁与稀硝酸反应:3Fe+8H++2NO-3 = 3Fe2++2NO↑+4H2O
D、Fe2O3溶于过量的氢碘酸溶液中:Fe2O3+6H+ = 2Fe3++3H2O
11.A、B两个烧杯中分别盛80mL 3.0mol·L-1的盐酸和氢氧化钠溶液,再分别加入等质量的铝粉,在相同状况下产生气体的体积比为A:B=2:5,则加入铝粉的质量为
A.2.7g B.6.48g C.5.4g D.4.05g
12.下列物质之间的转化都能一步能实现的是
A.Cu→CuO→Cu(OH)2→CuSO4→CuCO3
B.Al→Al2O3→NaAlO2→Al(OH)3→Al2O3→Al
C.N2→NH3→NO→NO2→HNO3→NO2
D.S→SO3→H2SO4→SO2→Na2SO3→Na2SO4
13.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
14.在铁与铜的混合物中加入一定量稀硝酸,充分反应后,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,则m1和m2的关系是
A.m1一定大于m2 B.m1可能等于m2 C.m1一定等于m2 D.m1可能小于m2
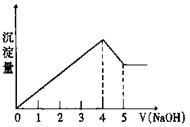 15.有一镁、铝合金,用适量稀硫酸恰好完全溶解,
15.有一镁、铝合金,用适量稀硫酸恰好完全溶解,
再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧
化钠的体积关系如右图所示,则原合金中镁、铝物
质的量比为
A.2∶1 B.4∶1
C.1∶1 D.1∶2
16.单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:
aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hNO2↑+kH2O
下列有关推断中,不正确的是
A.2d+3f = 3g+h B.反应中每消耗5.6 g Fe,转移0.2mol~0.3mol e-
C.HNO3的氧化性大于Fe3+ D.当a不变时,d随着b的增大而增大
第Ⅱ卷(共52分)
三、(本题包含两小题,共 16 分)
17.(8分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7
+ H2SO4(稀)![]() CO2↑+ K2SO4
+ Cr2 (SO4 )
3+ .
CO2↑+ K2SO4
+ Cr2 (SO4 )
3+ .
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是 ,氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生11g气体物质,则转移电子的数目为 。
18.(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a |
|
| |||||
|
|
|
| c | e | f | g |
|
|
|
| b | d |
|
| h |
|
⑴ a的一种核素核内有一个质子、一个中子,该核素的符号为 。
⑵ b、c、d、f、四种元素的原子半径由大到小的顺序为 (用元素符号表示)。
(3)c、d、e、h四种元素最高价氧化物对应的水合物的酸性由弱到强的顺序为(用化学式表示) 。
(4)从b、f形成的化合物与d、f形成的化合物的混合物中分离提纯d、f形成的化合物,可加入上述 (用元素符号表示)两种元素形成的化合物的水溶液后再过滤洗涤。
四、(本题包含两小题,共14分)
19.(8分)工业上硫酸亚铁是生产颜料氧化铁红的原料,其化学方程式为:
2FeSO4 高温==== Fe2O3+SO2↑+SO3↑。为了检验FeSO4高温分解的产物,某研究性学习小组进行了如下实验操作:
⑴ 取少量FeSO4高温分解得到的固体残渣,加一定量稀硝酸溶解,向该溶液中加入适量的KSCN,观察溶液颜色的变化。
甲同学认为根据溶液颜色变成_________色,可以证明FeSO4高温分解的产物中有Fe2O3。你认为甲同学的判断正确吗?_____ (填“正确”或“不正确”),理由是_____
_____________________________________________________________________。
⑵乙同学先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
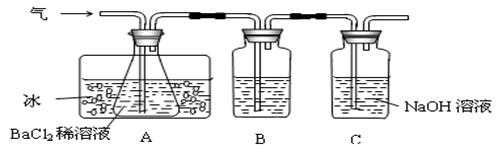
已知:SO2的沸点为-10℃,请回答相关问题:
①A瓶所盛试剂的作用是__________________________________;B瓶所盛的试剂是___________;C瓶所盛试剂的作用是________________________________________。
②A瓶要用冷水冷却的原因是________________________________________。
③将此反应生成的气体通入A瓶BaCl2溶液中,则_________。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
20.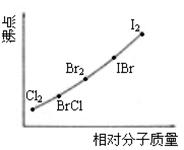 (6分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。
(6分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。
已知:卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
试回答下列问题:
(1)写出KI与IBr反应的化学方程式______________。
(2)右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________ 。
(3)试推测ICl的沸点所处的最小范围______________ 。
五、(本题包含两小题,共14分)
21.(8分)下图是中学化学中常见的一些单质或化合物之间的转化关系图,其中部分反应中涉及到的水未列出。已知A是厨房中最常见的调味品,B、F是人类生存必不可少的物质,E、H均为淡黄色固体粉末,且H单质存在于火山喷口附近,I、J均具有漂白性,但两者混合后的产物均不具有漂白性。
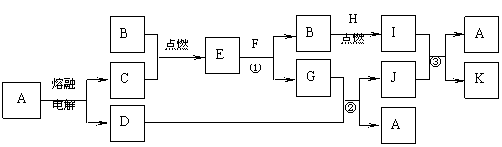
请回答下列问题:
⑴ A中的金属元素在元素周期表中的位置为 。
⑵ H的化学式为 。
⑶ 已知J的水溶液显较强的碱性,且反应③中有水生成。写出下列反应的离子方程式:
反应① ,反应② ,反应③ 。
22.(6分)单质溴微溶于水形成棕红色溴水。向溴水中通入SO2气体,溴水变成无色溶液,将该无色溶液分成两份,向其中一份中滴加AgNO3溶液生成淡黄色的AgBr沉淀。向另一份无色溶液中滴加双氧水(H2O2),溶液变成红棕色。回答下列问题:
⑴ 写出溴水中通入SO2气体时反应的离子方程式 。
⑵ 将无色溶液中滴加双氧水时反应的离子方程式补充完整:
▲ H2O2+ ▲ Br-+ ▲ ▲ = ▲ Br2+ ▲ ▲
⑶ 由上述反应可知,Br2的氧化性 (填“大于”或“小于”,下同)H2O2,SO2的还原性 Br-。
六.(本题包含一小题,共8分)
23.(8分)实验室需配制4.6 mol·L-1的H2SO4溶液100mL。
⑴ 需要浓度为18.4 mol·L-1的浓硫酸 mL。
⑵ 需要用的玻璃仪器除烧杯、量筒外还有 。
⑶ 向50 mL浓度为18.4 mol·L-1的浓硫酸中加入过量的锌使H2SO4全部反应,生成标准状况下的气体16.8L。
计算:
① 反应中消耗的锌的质量;
②反应中生成的氢气在标准状况下的体积
高一化学竞赛答题卷
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
17.(1)
(2) , (3) (4)
18.(1) (2)
(3) (4)
19.(1) , ,
。
(2)①____________________ ; _______ ; __________________。
②
③ 。
20.(1)
(2)
(3)
21.(1) (2)
(3)①____________________
②_______________________________ 。
③ 。
22.(1)
(2)
(3) ,
23.(1)
(2)
(3)解:
竞赛试题参考答案
1.B 2.C 3.C 4.B 5.D 6.A 7.A 8.B
9.B 10.AD 11.C 12.BC 13.AD 14.A 15.D 16.D
17.(1)3 2 8 3 2 2 8 H2O (2)K2Cr2O7 CO2 (3)A (4)NA
18.(每小题2分,本题共8分。)
⑴![]() ⑵Al>Si>C>O ⑶HClO4、HNO3、H2CO3、H2SiO3 ⑷ H、Cl
⑵Al>Si>C>O ⑶HClO4、HNO3、H2CO3、H2SiO3 ⑷ H、Cl
19.(8分) ⑴血红 (1分) 不正确 (1分) 溶液变血红色,只能证明有Fe3+,并不能证明有Fe2O3,而且Fe3+可能是硝酸将Fe2+氧化得到的 (1分)
⑵ ①检验并吸收SO3;(1分) 品红试液;(1分) 吸收SO2;(1分)
②SO3与H2O反应并放出大量的热;(1分)
③B、D(1分 )
21.(每空2分,本题共10分。)
⑴ 第三周期第IA族 ⑵ S ⑶ 2Na2O2+2H2O=4Na++4OH-+O2↑
Cl2+2OH-=Cl-+ClO-+H2O SO2+ClO-+2OH-=SO42-+Cl-+H2O
22.(第⑴小题4分,第⑵、⑶小题各2分。本题共8分。)
⑴ Br2+SO2+2H2O=4H++2Br-+SO42-
⑵ H2O2+2Br-+2H+=Br2+2H2O ⑶ 小于 大于
23.(本题共8分。)
⑴ 25.0(2分) ⑵ 100mL容量瓶、胶头滴管、玻璃棒(2分)
⑶ 解:设与浓硫酸反应消耗的Zn的物质的量为x,与稀硫酸反应的Zn的物质的量为y。
则:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O Zn+H2SO4=ZnSO4+H2↑
x 2x x y y y
2x+y=0.05L×18.4 mol·L-1 x+y=16.8L÷22.4 L·mol-1
解得:x=0.17 mol y=0.58 mol
反应中消耗的Zn的质量为 :(0.17 mol+0.58 mol)×65 g·mol-1=48.75g (2分)
反应中生成的在标准状况下的为0.58 mol×22.4 L·mol-1=12.99 L (2分)