高一化学第一学期强化班三校期终联考试题
化学试卷 命题人:蒋朝阳 审核人:严华慧
注意:1、本卷分第Ⅰ卷选择题和第Ⅱ卷非选择题两部分,试卷满分100分,考试时间90分钟。
2、本卷可能用到得原子量:H—1 Al—27 O—16 Fe—56 Cu—64
Mg—24 D—2
第Ⅰ卷(选择题,共48分)
一、选择题(本题共8小题,每题只有一个正确答案,每题3分,共24分)
1、四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是
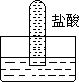

A B C D
2、世博园地区改造规划的实施将提升上海的环境质量。位于规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰。你估计这一空气污染物可能含有
A.FeO粉尘 B.P2O5粉尘 C.Fe2O3粉尘 D.SiO2粉尘
3、某晶体水溶液中加入Fe2+的溶液,再加稀HNO3溶液立即变红,另取该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是
A.KSCN B. NH4SCN C. NH4Cl D. FeCl3
4、等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5︰6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
5、下列离子方程式正确的是
A.漂白粉溶液中通入二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
B.将1molCl2通入含1molFeBr2的溶液中:2Cl2+2Fe2++2Br-=Br2+2Fe3++4Cl-
C.碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
D.水玻璃(硅酸钠水溶液)中滴加稀盐酸:Na2SiΟ3+2H+=H2SiO3↓+2Na+
6、下列叙述中正确的是
A. 两种元素构成的共价化合物分子中的化学键都是极性共价键
B. 分子晶体一定含有共价键,不含有离子键
C. 含有金属离子的晶体必是离子晶体
D. 只要含有阴离子,则此物质必有阳离子
7、已知X、Y、Z三种主族元素在周期表中的相对位置如图所示,且X的原子序数为a,下列说法不正确的是
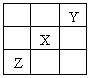 A.Y、Z的原子序数之和可能为2a
A.Y、Z的原子序数之和可能为2a
B.Y的原子序数可能是a-17
C.Z的原子序数可能是a+31
D.X、Y、Z一定都是短周期元素
8、下面列出了一定温度下每立方厘米活性炭所能吸附的常见气体的体积,分析下面的数据与气体的组成、性质等的关系,你认为下列结论正确的是
| 气体 | H2 | CO2 | O2 | N2 | Cl2 |
| 气体的沸点(℃) | -252 | -78 | -183 | -196 | -34 |
| 被吸附的体积(mL) | 4.5 | 97 | 35 | 11 | 494 |
A. 气体分子中所含原子个数多时,气体易被吸附
B. 沸点越低的气体,越易被吸附
C. 气体是化合物时,易被吸附
D. 气体的相对分子质量越大,越易被吸附
二、选择题(本题共8小题,每题有一个或两个正确答案,每题3分,若有两个正确答案只有全选并正确得3分,少选且正确得2分,不选或错选或多选得0分,共24分)
9、向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
A.NaCl Na2SO4 B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
10、以下化学用语正确的是
A.乙炔的结构式:CHCH B.乙酸的分子式:C2H4O2
C.明矾的化学式:KAlSO4·12H2O
D.氯化钠的电子式:![]()
11、NA表示阿伏加德罗常数,下列叙述中正确的是
A.0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA
B.标准状况下,11.2 L NO2和11.2 LN2O4的混合物所含的分子数为1.5 NA
C.2.0gD2O中所含中子数为0.1NA
D.常温常压下,22 g 氧气和26 g 臭氧所含氧原子总数为3 NA
12、有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A的一种核素的原子核为质子,B原子的最外层电子数是次外层电子数的2倍。B原子的最外层电子数是D、E原子最外层电子数之和,C原子的最外层电子数是D、F原子最外层电子数之和。下列推论正确的是
A.A、B两元素能形成多种化合物
B.D、E两元素的最高价氧化物对应的水化物均为强碱
C.C的气态氢化物的稳定性一定小于F的气态氢化物
D.C、F两种元素可能形成原子晶体型的新型无机非金属材料
13、为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A. 一定有SO32-离子
B.一定有CO32-离子
C.不能确定C1—离子是否存在
D.不能确定HCO3-离子是否存在
14、X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.Y、Z两元素的简单离子的半径Y>Z
15、在硫酸铁溶液中,加入ag铜,完全溶解后,再加入bg铁,充分反应后得到cg残余固体,且a>c,则下列说法正确的是
A.残余固体全部是铜 B.残余固体可能是铁和铜的混合物
C.残余固体是铁,溶液中一定不含Cu2+ D.最后得到的溶液可能含有Fe3+
16、镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是
A.10g B.8g C.6g D.12g
第二卷(非选择题,共52分)
三、本题一小题10分
17、(10分)以下三例是常见的化学实验:
①CO2通入澄清的石灰水,溶液先浑浊后澄清;
②将稀盐酸逐滴滴入Na2CO3溶液,开始时无现象,后产生气体;
③将NaOH溶液逐滴滴入AlCl3溶液,先产生白色沉淀,后沉淀消失;
回答下列问题:
(1)每例中均可用前后两个化学方程式来说明变化的规律,试用简要文字,说明这两个反应间的关系:
(2)每例中若要保证后一个反应发生,必须具备的条件是什么?
。
(3)将各例中前后两个反应方程式叠加,写出一个总的方程式。
,
,
。
四、本题共两小题,共22分
18、(12分) 盐酸、硫酸和硝酸是中学阶段所常见的“三大酸”。现请就三大酸与金属铜反应情况,填空回答下列问题:
(1)我们知道,稀盐酸不与Cu反应。在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为 。
(2)在一定体积的18mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积 (填写“大于”、“等于”、或“小于”)lOOmL。
若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗? (填“同意”或“不同意”),原因是 。另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
19、(10分)(1)用地壳中某主要元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用。例如:
①光导纤维的主要成分是 ;
②目前应用最多的太阳能电池的光电转化材料是 。
(2)氮化硅Si3N4是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取。粉末状Si3N4对空气和水都不稳定。但将粉末状的Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到对水不稳定的Mg3N2。
①写出由SiCl4和NH3反应制取Si3N4的化学反应方程式:
;
②在Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中热处理的过程中,发生反应,反应过程中有Mg3N2生成。其化学方程式为:
;
③氮化硅Si3N4是一种高温结构材料,其优点是(只要求写出二种)。
、
五、本题一小题,共12分
20、(12分)下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。
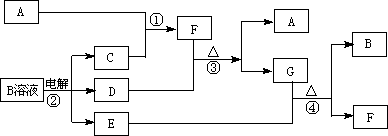
(1)写出化学式A ,D ,F ,写出电子式G ;
(2)鉴定G中阳离子的实验方法和现象__________________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式 、
。
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目 。
六、本题共一题(8分)
21、(8分)工业上利用氨催化氧化法可制取硝酸,加入脱水剂后制得较高浓度的硝酸。现以17吨氨作为原料,假设NH3全部转化为HNO3。
(1)写出NH3完全转化为HNO3的总化学反应方程式
(2)生产过程中需加水吸收,如果加入脱水剂与脱去水的量相等,则所得硝酸溶液的质量分数为多少?
(3)如果生产中同时制得50%的硝酸m1吨和90%的硝酸m2吨(脱去的水可循环使用,制得较低浓度的稀硝酸),若共加入27吨水,则m1与m2的质量比为多少?
 | |||
高一化学第一学期强化班三校期终联考试题
化学试卷答题纸
第Ⅰ卷(选择题,共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
三、本题一小题10分
17、(10分)(1)每例中均可用前后两个化学方程式来说明变化的规律,试用简要文字,说明这两个反应间的关系:
(2)每例中若要保证后一个反应发生,必须具备的条件是什么?
。
(3)将各例中前后两个反应方程式叠加,写出一个总的方程式。
四、本题共两小题,共22分
18、(12分)
(1)我们知道,稀盐酸不与Cu反应。在稀盐酸中加入H2O2后,则可使铜顺利溶解。
该反应的化学方程式为 。
(2)则浓硫酸的实际体积 (填写“大于”、“等于”、或“小于”)lOOmL
离子方程式为 。
(3)你同意这种看法吗? (填“同意”或“不同意”),原因是 。另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
19、(10分)①光导纤维的主要成分是 ;
②目前应用最多的太阳能电池的光电转化材料是 。
(2)①写出由SiCl4和NH3反应制取Si3N4的化学反应方程式:
;
②在Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中热处理的过程中,发生反应,反应过程中有Mg3N2生成。其化学方程式为:
;
③氮化硅Si3N4是一种高温结构材料,其优点是(只要求写出二种)。
、
五、本题一小题,共12分
20、(12分)(1)写出化学式A ,D ,F ,写出电子式G ;
(2)鉴定G中阳离子的实验方法和现象__________________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式 、
。
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目 。
六、
21、(8分)
(1)
(2)
(3
三校强化班联考答案
一、
1、C 2、C 3、B 4、B 5、B 6、D 7、D 8、D
二、
9、AB 10、B 11、D 12、AD 13、BC 14、A 15、A 16、A
三、
17、(1)两个反应是连续的 (2)前一个反应的两个反应物中,必有某个
反应物过量(3)①2CO2 + Ca(OH)2 = Ca(HCO3)2
②2HCl + Na2CO3 = 2NaCl +H2O + CO2↑
③4NaOH + AlCl3 = NaAlO2 + 3NaCl +2H2O(各2分)
四、
18、(1)![]()
![]() (2分) (2)PCl5 (3分) (3)P3N3Cl6 (3分)
(2分) (2)PCl5 (3分) (3)P3N3Cl6 (3分)
19、(1)①SiO2;②Si。(2)①3SiCl4+4NH3=Si3N4+12HCl;②Si3N4+6MgO=3SiO2+2Mg3N2;
③抗氧化、耐磨损、抗腐蚀、润滑性、抗冷热冲击等。(各2分)
五、
20、答案:(1)N2、Cl2、NH3、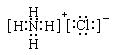 ; (共4分)
; (共4分)
(2)取少量D的溶液加人试管中,用胶头滴管加入少量NaOH浓溶液,加热 用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色(2分)
(3)2OH-+Cl2=ClO-+Cl-+H2O (2分) 8NH3+3Cl2![]() N2+6NH4Cl
(2分)
N2+6NH4Cl
(2分)
(4)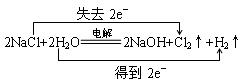 (2分)
(2分)
六、21、(1)NH3+2O2=HNO3+H2O
![]() (2)NH3 + 2O2 == HNO3 + H2O
(3) 0.5m1+(1-0.9)m2=27+18(H2O)
(2)NH3 + 2O2 == HNO3 + H2O
(3) 0.5m1+(1-0.9)m2=27+18(H2O)
17吨 63吨 18吨 0.5m1+0.9m2=63 (HNO3)
63吨/(63吨+18吨)×100%=77.8% m1/m2=19/5