高一化学第一学期月考试卷
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5
第Ⅰ卷(选择题共44分)
一.选择题(每小题只有一个选项符合题意,2分×10)
1.我国的“神州五号”载人飞船发射成功,“嫦娥”探月正在进行。据科学家预测,月球的土壤中吸附着数百万吨的23He,每百吨23He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以24He的形式存在。下列说法正确的是
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.32He和42He为同一种核素
2.如今人们把食品分为绿色食品、蓝色食品、白色食品等类型。绿色植物通过光合作用转化的食品叫绿色食品;而直接从海洋获取的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品。下面属于蓝色食品的是 ……
A.食醋 B.面粉 C.海带 D.白酒
3.下列物质属于强电解质的是……
A.HClO B.Cl2 C. Na2CO3 D. C2H5OH
4.水既不作氧化剂,也不作还原剂的氧化还原反应是
A.2F2+H2O=4HF+O2↑ B.2Na+2H2O=2NaOH+H2↑
C.Na2O+H2O=2NaOH D.2Na2O2+2H2O=4NaOH+O2↑
5.二氧化氯(ClO2)是一种具有和氯气相似的刺激性气味的气体,沸点为11℃,常温下在水中的溶解度为2.9g/L。它是一种更安全的高效消毒剂,它的氧化能力是氯气的2.5倍,现在已普遍用它替代氯气对自来水进行消毒。下列关于二氧化氯说法错误的是
A.通入二氧化氯气体不能使KI-淀粉溶液变色
B.二氧化氯的摩尔质量为67.5 g ·molˉ1
C.二氧化氯具有消毒性能是因为它具有很强的氧化性
D.二氧化氯中氯元素的化合价为+4价
6.除去镁粉中混有的少量铝粉,可选用的试剂是
A.盐酸 B.硫酸 C.氨水 D.氢氧化钾溶液
7.金属钠分别和下列各物质的水溶液反应时既有气体产生,又有沉淀生成的是
A.(NH4)2SO4 B.NaHCO3 C.BaCl2 D.CuSO4
8.铝热反应可冶炼难熔金属,铝热剂是
A.混合物 B.纯净物 C.氧化物 D.单质
9.下列说法不正确的是
A.通过电解熔融的无水MgCl2可以制得金属镁
B.镁条在空气中燃烧所得的固体物质是混合物
C.氧化镁是优质的耐火材料
D.金属镁质地柔软,不适宜制作高强度的合金材料
10.“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
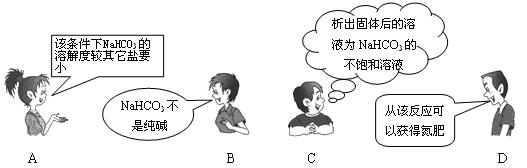
二.选择题(每小题有一个或两个选项符合题意3分×8)
11.某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是
A.Al3+、NO3ˉ、K+、SO42ˉ B.Ca2+、H+、HCO3ˉ、Na+
C.OHˉ、CO32-、Cu2+、SO42ˉ D.Na+、Mg2+、NO3ˉ、Clˉ
12.下列离子方程式中正确的是
A.铜片置于FeCl3溶液中:Cu + Fe3+ = Fe2+ + Cu2+
B.大理石与盐酸反应:CO32ˉ+ 2 H+ = CO2↑ + H2O
C.AlCl3溶液中滴入过量的氨水:Al3+ + 3 OHˉ= Al(OH)3↓
D.氢氧化铝和氢氧化钠溶液反应:Al(OH)3 + OHˉ= AlO2ˉ+ 2 H2O
13.下列溶液中Cl-的物质量浓度与50 ml 1mol/LAlCl3溶液中Cl—的物质的量浓度相等的是
A.150 mL 3 mol/LKCl溶液 B.75 mL 1 mol/LFeCl3溶液
C.150 mL 1 mol/LMgCl2溶液 D.75 mL 3 mol/LCuCl2溶液
14.Al分别与足量的稀盐酸和NaOH溶液反应,当两个反应放出的气体体积在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为
A.2∶1 B.1∶2 C.3∶1 D.1∶3
15.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是…
| 选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
| A | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| B | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| C | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| D | CO(H2) | 氧气 | 点燃 |
16.现有NaCl、MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl六种溶液,如果只用一种试剂把它们鉴别开来,应选用的试剂是
A.浓NaOH B.AgNO3 C.浓氨水 D.H2SO4
17.向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
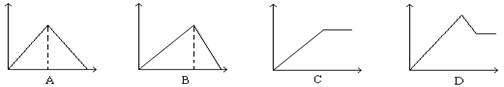
18.已知:2NaOH +H2S = Na2S + 2H2O;Na2S + H2S = 2NaHS。在含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中可能含有的物质是
A.Na2S B.NaHS C.Na2S和NaHS D.NaOH和Na2S
第Ⅱ卷(非选择题共56分)
三.实验题
19.(12分)海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
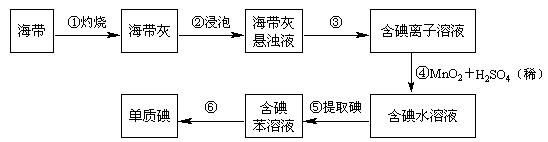 请填写下列空白:
请填写下列空白:
(1)步骤③的实验操作名称是 ; 步骤⑤的实验操作名称是 。
(2)步骤④的反应也可以用高锰酸钾作氧化剂,配平该化学方程式:
□KI+□KMnO4+□H2SO4—□K2SO4+□MnSO4+□I2+□H2O
(3)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:
。
20.(9分)有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、
Al3+、 Fe3+、SO42-、CO32-、Cl-、I-中的一种或几种,取该溶液进行如下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
(3)取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的上述离子有 ,肯定不存在的上述离子有 ,还不能确定是否存在的离子有______________。
四.填空题
21.(9分)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式: ;
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是: ;
此时最好用含氢氧化铝的胃药(如胃舒平)离子方程式: 。
22.(12分)某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
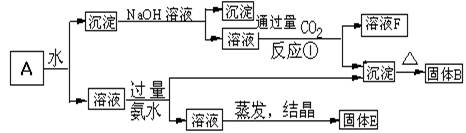 |
据此判断:
(1)固体B所含物质的化学式为 ;
(2)固体E所含物质的化学式为 ,其投入足量热的氢氧化钡溶液中发生反应的离子方程式 ;
(3)写出反应①的离子方程式(或化学方程式) 。
五.计算题
23.(6分)取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112 ml CO2(标准状况)。
求(1)稀盐酸物质的量浓度
(2)Na2CO3·xH2O的摩尔质量
(3)x值
24.(8分)为测定镁铝合金中各金属的含量,取一定量的镁铝合金完全溶于足量的6 mol·Lˉ1盐酸,在标准状况下收集到8.96升H2,在所得溶液中加入过量的氢氧化钠溶液充分反应后过滤,生成的沉淀经洗涤.干燥.称重质量为5.8 g。求
(1)收集到的氢气的物质的量为多少?
(2)原合金中镁、铝的质量分别是多少g?
高一化学第一学期月考试卷
高一化学试卷答卷纸
选择题(1-10题20分,11-18题24分,共44分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| |
| |||||||||
三.实验题(两小题,共21分)
19.(12分)(1)
(2)□KI+□KMnO4+□H2SO4—□K2SO4+□MnSO4+□I2+□H2O
(3)
20.(9分)
肯定存在的离子有 ,肯定不存在的离子有 ,
还不能确定是否存在的离子有______________。
四.填空题(两小题,共21分)
21.(9分)
离子方程式: ;
原因是: ;
离子方程式: 。
22.(12分)
(1) ;
(2) , ;
(3) 。
五.计算题(两小题,共14分)
23.(6分)
24.(8分)
高一化学第一学期月考试卷
高一化学试卷参考答案
选择题(1-10题20分,11-18题24分,共44分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | C | C | D | A | D | D | A | D | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| |
| AD | D | AB | C | B | D | D | CD |
| |
三.实验题(两小题,共21分)
19.(12分)(1) 过滤 (3分) 萃取并分液 (3分)
(2)10,2,8,6,2,5,8 (3分)
(3) 取少量的水溶液滴几滴淀粉溶液变蓝的还有单质碘不变蓝的没有碘了 (3分)
20.(9分)I-、NH4+、Ba2+;(3分)SO42-、CO32-、Mg2+、Al3+、Fe3+;(3分)
K+、Na +、Cl-(3分)
四.填空题(两小题,共21分)
21.(9分)HCO3-+H+=CO2↑+H2O;因产生CO2压力增大而加剧胃壁穿孔;Al(OH)3+3H+=Al3++3H2O;
22.(12分)(1)Al2O3 (3分) (2)NH4SO4(3分),
2NH4+ + SO42- + Ba2+ 2OH- = BaSO4↓ + 2NH3↑ + 2H2O;(3分)
(3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- [或:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3](3分)
五.计算题(两小题,共14分)
23.(1)5mol/L (2分)
(2)286g/mol (2分) (3)x == 10 (2分)
24.(1)0.4 mol(2分);(2)镁2.4 g;铝5.4 g;(各3分)