高一化学卤素上期练习试卷 卤素(四)
![]() 《卤 素》
单元检测题
《卤 素》
单元检测题
说明:
1、本试卷分第Ⅰ卷和第Ⅱ卷,共四道大题24道小题。考试时间90分钟,满分108分。
2、答题前,先将班级、姓名、座号等正确填写在答卷指定的区域内。所有试题的答案都必须工整书写在答卷规定的位置,否则无效。
3、可能需要的相对原子质量数据:H 1 Li 7 C 12 S 32 Na 23 O 16 F19 Cl 35.5 K 39 Rb 85 Cs 133
 第Ⅰ卷(选择题 共48分)
第Ⅰ卷(选择题 共48分)
一、选择题(每小题只有1个正确答案, 每小题3分,共48分)
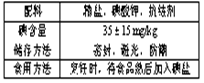
1 (2007年高考理综重庆卷)表中是食用碘盐包装上的部分说明,
下列说法正确的是( )
(A)高温会导致碘的损失 (B)碘酸钾可氧化氯化钠
(C)可用淀粉检验碘盐中的碘酸钾 (D)该碘盐中碘酸钾含量为20 mg/kg~50 mg/kg
2.下列物质的用途与其性质的对应关系错误的是:
A.氯气用于自来水消毒— 次氯酸的强氧化性 B. 碘化银用于人工降雨— 使空气中水蒸汽凝聚
C.氢氟酸腐蚀玻璃— 强酸性 D. 溴化银用于照相术— 光照分解
3.砹是原子序数最大的卤族元素,推测砹的化合物不可能具有的性质是( )
A. 砹是有色固体 B. HAt很稳定 C. AgAt难溶于水 D. 砹易溶于某些有机溶剂
4.向溴化钠、碘化钠的混合溶液中通入足量氯气,之后加热,将溶液蒸干,并灼烧片刻,最后残留的物质是( )
A. NaCl B. NaCl NaBr NaI C. NaBr NaI D. NaI
5.将19gF2通入81g水中,所得溶液中溶质质量分数是 ( )
A. 19% B. 20% C. 21.7% D. 27.5%
6.下列各组物质,不用任何化学试剂即可鉴别的是 ( )
A. NaCl溶液、NaBr溶液、KI溶液 B. 氯水、NaBr溶液、盐酸
C. 氯化氢、溴化氢、碘化氢 D. 盐酸、NaCl溶液、AgNO3溶液、Na2CO3溶液
7.下列关于电解质、非电解质的说法正确的是
A、氯气溶于水得氯水,该溶液能导电,因此氯气是电解质
B、CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质
C、导电能力弱的溶液肯定是弱电解质的溶液
D、HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质
8.(2007年高考广东化学卷,卤素)氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
(A)若管道漏气遇氨就会产生白烟 (B)该反应属于复分解反应
(C)该反应利用了Cl2的强氧化性 (D)生成1 mol N2有6 mol电子转移
9.下列性质比较正确的是: ( )
A.热稳定性:Na2CO3 >H2CO3>NaHCO3 B.氧化性:Li+> Na+> K+>Rb+>Cs+
C.氢卤酸的酸性:HF> HCl>HBr>HI D.熔点: Cs>Rb>K>Na>Li
10.氟是最活泼的非金属,能体现这个结论的是 ( )
A. 氢氟酸是弱酸 B. 氢氟酸是剧毒 C. NaF是农药 D. 氟有XeF2、KrF2等化合物
11. 潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,是因为它们均含有( )
A. 氯气 B. 次氯酸 C. 次氯酸根 D. 氯化氢
12.在盛有KI溶液的试管中,滴入氯水充分反应后,再加四氯化碳振荡,静置后观察到的现象是 ( )
A. 上层紫红色,下层接近无色 B. 均匀、透明、紫红色 C. 均匀、透明、无色 D. 上层接近无色,下层紫红色
13.卤素从F到I性质递变规律正确的是( )
①单质的氧化性增加 ②单质颜色加深 ③单质沸点升高 ④气态氢化物稳定性增强
⑤气态氢化物水溶液酸性增强 ⑥离子半径逐渐增大,还原性逐渐增强
A.①③⑤ B.②④⑥ C.②③⑤⑥ D.①④⑤⑥
14.某温度下,将Cl2通入氢氧化钾溶液中,反应后得到KCl、KclO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A. 2:3 B. 4:3 C. 10:3 D. 11:3
1515、使相同摩尔浓度的NaCl、MgCl2、AlCl3溶液中的Cl-离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为3:2:1,则上述三种溶液的体积比是
(A)9:4:1 (B) 9:3:1 (C)6:3:2 (D) 3:2:1
16、将标准状况下的a升氯化氢气体溶于1000克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是( )
A
![]() B
B ![]() C
C ![]() D
D ![]()
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 选 项 | [A] | [A] | [A] | [A] | [A] | [A] | [A] | [A] | [A] | [A] | [A] | [A] | [A] | [A] | [A] | [A] |
| [B] | [B] | [B] | [B] | [B] | [B] | [B] | [B] | [B] | [B] | [B] | [B] | [B] | [B] | [B] | [B] | |
| [C] | [C] | [C] | [C] | [C] | [C] | [C] | [C] | [C] | [C] | [C] | [C] | [C] | [C] | [C] | [C] | |
| [D] | [D] | [D] | [D] | [D] | [D] | [D] | [D] | [D] | [D] | [D] | [D] | [D] | [D] | [D] | [D] |
第Ⅱ卷(非选择题 共60分)
二、填空题(共32分)
17、卤化氢皆为 色,卤素为 价的气体,气体溶于水呈 性,其中酸性最弱的是(写化学式) ,酸性最强的是 ,卤化氢的稳定性______>______>_______>_______。(5分)
18 (16分) (1)(4分) 氯水中含有多种成分.将紫色石蕊试液滴入石蕊中,溶液显红色,起作用的成分主要是 ;过一会儿,溶液的颜色逐渐褪去,起作用的成分是 。往氯水中滴入硝酸银溶液,产生白色沉淀,起作用的成分是 。氯水能使淀粉碘化钾试纸变蓝,起作用的成分是 。(以上空白均填化学式)
(2)法医做指纹实验时,常用AgNO3溶液喷洒指纹,经过处理后会出现黑色的纹路,请用化学方程式表示其原理是:
① 。② 。(4分)
(3)(4分)已知反应 ①过氧化钠与水反应 ②氧化钠与水反应 ③钠与水反应 ④2F2 + 2H2O = 4HF + O2
根据上述反应,试填序号回答:
(1)上述反应中不属于氧化还原反应的有_________(2)水被氧化的有_______.
(3)水被还原的有_______.(4)是氧化还原反应,但水既不被氧化、又不被还原的是________.
(4) (4分) KClO3和浓盐酸在一定条件反应会生成绿黄色的易爆物二氧化氯,化学反应方程式如下:
2KClO3 + 4HCl = 2KCl + 2ClO2↑+ Cl2↑+ 2H2O⑴浓盐酸在反应中显示出来的性质是 ;
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
⑵产生0.1 mol Cl2 ,则转移的电子总数约为______________________
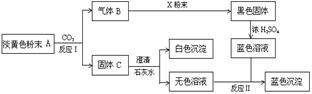 19(11分)物质有以下转化关系:
19(11分)物质有以下转化关系:
根据上图和实验现象,回答下列问题:(用化学式表示)
(1) A是 ,B是 ,C是 ,X粉末是 。
(2)确认A中阳离子的实验方法是 。
(3)写出反应Ⅰ的化学方程式 。
(4)写出反应Ⅱ的离子方程式 。
(5)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为 L,反应过程中转移电子的物质的量为 mol。
三、实验题(13分)
20、(9分)海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
![]()
(1)提出提取碘的过程中有关的实验操作名称:① ③ ;
写出过程②中的有关反应的化学方程式 。
在过程②反应中的氧化剂是_______, 还原剂是_______若生成1mol的单质生成物共转移了 mol的电子。
(2)提取碘的过程中,可供选择的有机试剂有
A.四氯化碳 B.汽油 C.酒精 D.醋酸
21、为检验某碳酸钠溶液中混有的溴化钠,进行如下实验:(4分)
| 实验步骤 | 实验现象 | 简 答 |
| 取样,加入过量的稀硝酸 | 加硝酸的目的是: | |
| 加入硝酸银溶液 | 反应的化学方程式为: |
四、计算题(15分)
22、(3分)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。(2007年高考上海化学卷)
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
23、(6分) (1)在标准状况下,将4.2gNaHCO3和过量的200ml HCl制CO2,理论上制备CO2多少L?
(已知:NaHCO3+ HCl=NaCl+ H 2 O+ CO2 ↑)
(2)实际上由于一部分CO2溶解在反应后的混和溶液中,收集的CO2气体减少,已知每升溶液能溶解CO2 1.2L,则实际收集CO2多少升?(假设溶液体积变化忽略不计)
(3)如果某学生将实际质量为13.2g的NaHCO3错误地放在托盘天平的右盘上进行称量(5克以下用游码),根据他的称量结果进行计算,这些NaHCO3加热分解放出CO2的物质的量为多少?
※24.(6分)取软锰矿17.4g(主要成分为MnO2,其杂质不与浓盐酸反应)与足量的浓盐酸反应后,将生成的Cl2通入到200mL NaBr溶液中(其中含22g NaBr),经加热蒸发水分并烘干后,得到质量为13.1g的残渣。试计算:
(1)通入Cl2后,溶液中NaCl的物质的量浓度(忽略溶液的体积变化)
(2)软锰矿中MnO2的质量分数
卤素 垫江师范学校高2010级高一上期化学练习试卷3卤 素(四)
《卤 素》 单元检测题
参考答案:
1、A 2、C 3、B 4、A 5、C 6、B 7、D 8、B 9、B 10、D 11、B 12、D13、C 14、D 15、B 16、D
二、填空题(共33分)
17、无,-1,酸,HF,HI,HF>HCl>HBr>HI
|
(2)(4分)AgNO3 + NaCl = AgCl ↓+ NaNO3 ;2AgNO3 = 2Ag + Cl2↑
(3)(4分)、② ④ ③ ①
(4)(4分)(1)②(2)1.204×1023
19.(共11分,)
(1) A是 Na2O2 ,B是 O2 ,C是 Na2CO3 ,X粉末是 Cu 。
(2)确认A中阳离子的实验方法是 焰色反应 。
(3)写出反应Ⅰ的化学方程式2Na2O2+2CO2 =2Na2CO3+O2 。
(4)写出反应Ⅱ的离子方程式 Cu2++2OH- =Cu(OH)2↓ 。
(5)若参加反应的A的质量为39g,则消耗CO2的体积为11.2 L,反应过程中转移电子的物质的量为 0.5 mol。
三、实验题(13分)
20、(9分)(1) ①过滤 ③ 萃取; Cl2 + 2KI == 2KCl + I2 ;Cl2 、KI 、 2
(2) A B (此题每空2分)
21、(4分)
| 实验现象 | 简 答 |
| 产生大量气泡 | 除去CO32-,防止碳酸钠对溴化钠检验的干扰 |
| 产生浅黄色沉淀 | AgNO3 +Na Br → Ag Br↓+NaNO3 |
D.
三、计算题(12分)
22[答案](1)10.7%。 (2)0.25。 (3)3:2。
23、(6分)(1)1.12升(3分)(2)0.88升(3分)(3)0.1mol(4分)
24、⑴.1mol/L ⑵.8.7g ; 50%
| |