高一化学反应与能量单元测试题
可能用到的原子量:
H = 1 C = 12 N = 14 O = 16 Na = 23 Al = 27
高一( )班 姓名 座号 成绩
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
一、选择题:( 共10个小题,每小题只有一个选项符合题意,每题3分,共30分。)
1、对于放热反应H2 + Cl2 点燃 2HCl,下列说法正确的是:
A、产物所具有的总能量高于反应物所具有的总能量
B、反应物所具有的总能量高于产物所具有的总能量
C、断开1mol H—H键和1mol Cl—Cl键所吸收的总能量小于形成
1mol H—Cl键所放出的能量
D、该反应中,热能转变为化学能
2、下列反应既属于氧化还原反应,又是吸热反应的是:
A、锌粒与稀硫酸的反应
B、灼热的木炭与CO2的反应
C、甲烷在空气中燃烧的反应
D、Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
3、下列各组中的两个反应,前一个反应放出的热量比后一个反应放出的热量多的是(反应物参与反应的物质的量均按化学方程中的化学计量数计算)
![]() ① 2H2(g)+ O2(g)
= 2H2O(g) 2H2(g)+
O2(g) = 2H2O(l)
① 2H2(g)+ O2(g)
= 2H2O(g) 2H2(g)+
O2(g) = 2H2O(l)
② C(s)+ O2(g) = CO2(g) C(s)+ O2(g) = CO(g)
A、只有① B、只有② C、①② D、①②都不符合题意
4、氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是
A、 H2通入负极区 B、O2通入正极区
C、负极反应为2H2 + 4OH- — 4e- = 4H2O D、正极发生氧化反应
5、X,Y,Z都是金属,在X与稀H2SO4反应中,加入少量Z的硫酸盐溶液时能使反应加快;X与Y组成原电池时,Y电极质量减少,X,Y,Z三种金属的活动性顺序为:
A、X>Y>Z B、X>Z>Y C、Y>X>Z D、Y>Z>X
6、在反应:C + CO2 ≒ 2CO中,可使反应速率增大的措施是:
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A、①②③④ B、②③④⑤ C、①②③ D、②③④
7、可逆反应2SO2
+ O2 ![]() 2SO3达到平衡的标志是
2SO3达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
A、①② B、①③ C、只有③ D、只有①
8、将1mol N2和3 mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1 mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率。① Ʋ(N2) = 0.15 mol/(L·min) ② Ʋ(N2) = 1.05 mol/(L·min)
③ Ʋ(NH3) = 0.30 mol/(L·min) 其中正确的是
A、①② B、②③ C、①③ D、①②③
![]() 9、已知可逆反应2SO2 + O2 2SO3,当生成2 mol SO3时放出热量为Q,
9、已知可逆反应2SO2 + O2 2SO3,当生成2 mol SO3时放出热量为Q,
![]() 现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则
现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则
A、Q1 = Q B、Q1 < Q C、2Q1 > Q D、无法判断
10、将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是
①使煤充分燃烧,提高煤能的利用率 ②减少SO2的产生,避免造成“酸雨”③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A、①②③ B、②③④ C、①③④ D、①②③④
二、选择题:( 共9个小题,每题有1~2个选项符合题意,每题4分,共36分。)
11、下列变化一定是吸热反应的是:
A、凡需加热后才能发生的反应 B、所有的分解反应
C、将热能转变为化学能的反应 D、生成物总能量大于反应物总能量的反应
12、化学反应的特征是
A、发光发热 B、能量发生变化 C、状态发生变化 D、有新物质生成
13、下列变化是因原电池反应而引起的是
A、在空气中金属铝表面迅速氧化形成保护膜
B、常温下,铁被浓硫酸“钝化”形成保护膜
C、在潮湿的空气中钢铁易生锈 D、在潮湿的空气中过氧化钠易变质
14、下列措施对增大反应速率明显有效的是:
A、Na与水反应时增大水的用量 B、Fe与稀硫酸反应制取氢气时,改用浓硫酸
C、在K2SO4与BaCl2两溶液反应时,增大压强
D、将铝片改为铝粉,做铝与氧气反应的实验
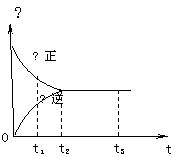 15、右图是可逆反应X2 + 3Y2
15、右图是可逆反应X2 + 3Y2 ![]() 2Z2 在反应
2Z2 在反应
过程中的反应速率(Ʋ)与时间(t)的关系曲线,
下列叙述正确的是
A、t1时,只有正方向反应
B、t2时,反应到达限度
C、t2- t3,反应不再发生
D、t2- t3,各物质的浓度不再发生变化
16、金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
A、Q1 < Q2 B、石墨不如金刚石稳定
C、石墨具有的能量比金刚石低 D、石墨与金刚石完全燃烧,生成的二氧化碳一样多
17、一定温度下可逆反应N2(g) + 3H2(g) ≒ 2NH3(g)达平衡的标准是:(分别用V表示正反应速率,V╯表示逆反应速率)
A、V(N2) = V╯(N2) B、V(N2) = 3V(H2)
C、V(H2) = 3/2V╯(NH3) D、N2,H2,NH3的体积比为1:3:2
18、下列实验中,反应速率加快是由催化剂引起的是:
A、在炭粉中加入KClO3,点燃时燃烧更为剧烈
B、锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快
C、固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀
D、双氧水中加入少量MnO2,即可迅速放出气体
19、在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
A、0.1mol.L-1.min-1 B、0.2mol.L-1.min-1 C、0.3mol.L-1.min-1 D、0.6mol.L-1.min-1
二、非选择题(共34分)
20.(3分)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) k J的热量。
21.(8分)由铜、锌和稀盐酸组成的原电池中,铜是 极,发生 反应,电极反应式是 ;锌是 极,发生 反应,电极反应式是 。
22.(4分)指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭 ,(2)给手机的电池充电 ,(3)用畜电池点亮灯泡 ,
(4)电解水得到O2和H2 。
23.(4分)以锌、石墨棒为两极,硫酸铜溶液为电解液组成的原电池的正极反应式是
负极反应式是 。
24.(2分)某反应是吸热反应,且所吸收的热能由外部热源(如酒精灯)提供,提供的热能主要起到 的作用。
![]() 25.(4分)在密闭容器中发生3X(g)+Y(g) Z (g)+2W(g)反应,现在控制下列三种不同的条件:
25.(4分)在密闭容器中发生3X(g)+Y(g) Z (g)+2W(g)反应,现在控制下列三种不同的条件:
①在400°C时,9molX与3molY反应
②在400°C时,15 molX与5molY反应
③在300°C 时,9molX与3molY反应
那么,反应开始时,正反应速率最大的是(填序号,下同) ,
正反应速率最小的是 。
26.(9分)现有如下两个反应:(A)NaOH + HCl = NaCl + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池
(2)如果不能,说明其原因
(3)如果可以,则写出正、负极材料及其电极反应式,电解质溶液名称
。
参考答案和评分标准:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | B | D | C | C | C | C | B | A | CD | BD | C | D | BD | B | AC | B |
三.(每空2分,共10分)
21.(8分)正;还原 ; 2H++2e-=H2↑;负;氧化反应; Zn--2e-=Zn2+ ;
22.(4分) (1)化学能变热能,(2)电能变化学能,(3)化学能变电能 (4) 电能变化学能
23.(4分)Cu2+ + 2e–= Cu; Zn ―2e–= Zn2+
24.(4分)破坏反应物中的化学键
25.(4分)②; ③
26(1)(A)不能,(B)可以(各1分)
(2)(A)的反应非氧化还原反应,没有电子转移(2分)
(3)负极:铜,Cu — 2e- = Cu2+
正极:碳棒,2Fe3+ + 2e- = 2Fe2+
电解质溶液:氯化铁溶液(各1分