高一化学反应与能量单元测验(A卷)
本试卷分选择题和非选择题两部分,共4页,满分100分,考试用时60分钟。
常用相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Cl:35.5 K:39 Ca:40 Cu:64 Zn:65 Ag:108
第一卷(48分)
一、选择题(每题4分,共48分,每题只有一个选项)
1.下列说法正确的是( )
A. 物质发生化学反应都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
D. 放热反应的发生无需任何条件
2.对化学反应限度的叙述,错误的是( )
A.任何可逆反应都有一定的限度
B.化学反应达到限度时,正逆反应速率相等
C.化学反应的限度与时间的长短无关
D.化学反应的限度是不可改变的
3.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
A.金刚石与石墨互为同位素
B.石墨不如金刚石稳定
C.金刚石不如石墨稳定
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多
4.铜片和锌片用导线连接后插入稀硫酸中,电解质溶液的pH( )
A.不变 B.先变小后边大 C.逐渐变大 D.逐渐变小
5.X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸银溶液中,Y表面有Z析出。其活泼顺序是( )
A. X>Y>Z B. Z>Y>X
C. X>Z>Y D. Y>X>Z
6. 甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少了2molA,则甲容器内的反应速率比乙容器内的反应速率要 ( )
A. 快 B. 慢 C. 相等 D. 无法判断
7.可逆反应H2(g)+I2(g)≒2HI(g)达到限度时的标志是( )
A.混合气体密度恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
|
|
A.12gC所具有的能量一定高于28gCO所具有的能量
B.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多
9.下列每组的三种物质中,两边的固体均有导线连接,插入中间的液体中,其中能组成原电池的是( )
A.ZnH2SO4(稀)C B.CuHNO3(稀)Ag
C.ZnCCl4Cu D.FeH2SO4(稀)Fe
10.对10mL1mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
A. 加入一定量的CaCl2 B. 加入5mL1.5mol/L的盐酸
C. 加入15mL0.5mol/L的盐酸 D. 加入5mLH2O
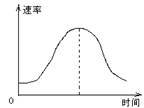 11.把镁条投入到盛有盐酸的敞口容器里,产生H2的
11.把镁条投入到盛有盐酸的敞口容器里,产生H2的
速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表
面积;③溶液的温度;④Cl-的浓度。影响反应速率的
因素是 ( )
A. ①④ B.③④
C.①②③ D.②③
12.对于可逆反应2SO2+O2≒2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子 ( )
A.只存在于O2中 B.只存在于O2和SO3中
C. 只存在于O2和SO2中 D. 存在于O2、SO2和SO3中
第二卷(52分)
二、填空题(17分)
13.(6分)煤矿常因瓦斯(CH4)爆炸而引起重大事故,为了避免事故的发生,特别要求矿井通风,严禁烟火,从反应条件的控制分析其理由
14.(5分)电工操作中规定,不能把铜线和铝线拧在一起连接线路,这是因为____________________________________________________________________________。
15.(6分)在铜、银和硝酸银构成的原电池工作时,正极为___________;当有1.6g铜溶解时,银棒增重_________________。
三、分析与设计题(23分)
16.(6分)盐酸与锌片反应时,若加入可溶性的固态醋酸铜[(CH3OOO)2Cu],将产生两种影响氢气生成速率的因素。其一是_________________________________,其二是________________________________________________。
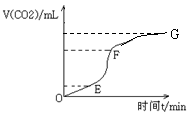
17.用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)(4分)实验过程如下图所示,分析判断:________段化学反应速率最快,_______段收集的二氧化碳气体最多。
(2)(4分)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
 A.蒸馏水
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸
(3)(4分)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答两种)
18.(5分)现有A、B两种金属分别与盐酸反应,产生氢气的速率相近。请设计一个原电池实验证明A、B两种金属的活动性?
四、计算题(12分)
19.可逆反应aA(g)+bB(g) ≒ cC( g)+dD(g),取a molA和b molB置于容器中,1min后,测得容器内A的浓度为x mol/l.这时B的浓度为多少?C的浓度为多少?这段时间内反应的平均速率若以物质A浓度变化来表示应为多少?
参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | A | D | C | C | A | D | B | A | A | B | C | D |
13. 矿井通风能降低瓦斯的浓度,并带走热量,严禁烟火是避免引燃甲烷,从而避免瓦斯爆炸。
14.在潮湿的空气中,铜与铝接触形成原电池,铝做负极,很快被腐蚀。
15.Ag;5.4g。
16. (1)Zn+Cu2+=Zn2++Cu,构成Zn(-)盐酸Cu(+)原电池,使产生H2速率加快;
(2)CH3COO-+H+=CH3COOH,降低c(H+),使产生H2速率减慢。
17. (1)EF、EF;(2)AC;(3)改用较大块的碳酸钙固体,或用与盐酸不反应的东西将碳酸钙部分包住,或加入醋酸钠溶液等。
18:将A、B两种金属片用导线连接放入盐酸中组成原电池,有气泡逸出的是较不活泼的金属,另一极即是活泼的金属。
19:bx/a mol.L-1;c(a-xV)/amol.L-1;(a-x)/V mol/(l.min)