高一化学反应与能量检测
首都师范大学大兴附属中学 高一化学组
一、选择题(每题有1个或2个选项符合题意)
1. 石油、煤、天然气等在地球上的蕴藏量是有限的,为缓解能源危机:①可以利用电解水的方法得到氢气做能源;②可用酒精做能源;③砍伐树木做能源;④应开发太阳能、核能等新能源。上述说法正确的是 ( )
A. 只有① B. ①和④ C. ②和④ D. ④
2. 下列反应中,反应物总能量低于生成物总能量的是 ( )
A. C + CO2 =2CO B. C + O2=CO2
C. C + H2O = CO + H2 D. C + CuO=CO2 + Cu
3. 原电池产生电流的本质原因是 ( )
A. 原电池中溶液能电离出自由移动的离子
B. 有两根导线将两个活泼性不同的电极连接
C. 电极上进行的氧化还原反应的生成物为电子
D. 电极上进行的氧化还原反应中发生了电子的转移
4. 下列关于化学反应速率的说法正确的是 ( )
A. 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B. 化学反应速率为“0.8mol/(L·s)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C. 根据化学反应速率的大小可以知道化学反应进行的快慢
D. 对于任何化学反应来说,反应速率越大,反应现象越明显
5. 用铁片与稀硫酸反应制氢气时,下列措施不能使反应速率加快的是 ( )
A. 加热 B. 不用稀硫酸,改用98%的浓硫酸
C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉
6. 下列说法正确的是 ( )
A. 若反应X + Y = M是放热反应,该反应一定不用加热。
B. 需要加热方能发生的反应一定是吸热反应。
C. CO2与CaO化合是放热反应,则CaCO3分解是吸热反应。
D. 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热。
7. 如图所示,各烧杯中均盛有海水,铁在其中被腐蚀由快到慢的顺序为 ( )
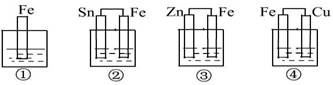
A. ②①③④ B. ④③①② C. ④②①③ D. ③②④①
8. 锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。 某种锂电池的总反应式是Li+MnO2 = LiMnO2。下列说法正确的是( )
A. Li是负极,电极反应为Li-e-=Li+
B. Li是正极,电极反应为Li+e-=Li-
C. MnO2是负极,电极反应为MnO2+e-=MnO2-
D. 锂电池是一种环保型电池
9. “摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质可能是 ( )
A. 氯化钠 B. 固体硝酸铵 C. 生石灰 D. 蔗糖
10. 对于反应A2+3B2=2C来说,以下化学反应速率的表示中,反应速率最快的是( )
A. v(B2)=0.8 mol/ (L·s) B. v(A2)=0.4 mol/ (L·s)
![]() C. v(C)=0.6 mol/ (L·s)
D. v(B2)=4.2 mol/ (L·s)
C. v(C)=0.6 mol/ (L·s)
D. v(B2)=4.2 mol/ (L·s)
11. 可逆反应H2(g)+I2(g) 2HI(g)达到平衡状态时的标志是 ( )
A. 混合气体的体积恒定不变 B. 混合气体的颜色不再改变
C. H2、I2、HI的浓度相等 D. I2在混合气体中的体积分数与H2在混合气体中的体积分数相等12.我国锅炉燃煤采用沸腾炉用鼓风机将煤粉吹起,成沸腾状况燃烧,采用沸腾炉的好处在于( )
A. 增大煤炭燃烧时放出的热量 B. 减少炉中杂质气体(如SO2等)的形成
C. 增大煤炭与氧气的接触几率,形成清洁能源D. 使得燃料燃烧充分,从而提高燃料的利用率
13. 根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为 ( )
A. X > Z > Y > W B. Z > W > X > Y C. Z > Y > X > W D. Z > X > Y > W
14.下列关于燃料充分燃烧的说法,不正确的是 ( )
A.空气量越多越好 B.应通入适量空气
C.固体燃料燃烧前要粉碎 D.液体燃料燃烧时可以以雾状喷出
15.下列化学电池不易造成环境污染的是 ( )
A.铅蓄电池 B.锌锰电池 C.镍镉电池 D.氢氧燃料电池
16.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是 ( )
A.10℃ 20mL 3mol/L的盐酸溶液 B.20℃ 10mL 4mol/L的盐酸溶液
![]() C.20℃ 20mL 2mol/L的盐酸溶液 D.20℃ 30mL 2mol/L的盐酸溶液
C.20℃ 20mL 2mol/L的盐酸溶液 D.20℃ 30mL 2mol/L的盐酸溶液
17.一定温度下,可逆反应3X(g)+Y(g) 2Z(g)达到限度的标志是 ( )
A.单位时间内生成3n mol X,同时消耗n mol Y B.X的生成速率与Z的生成速率相等
C.X、Y、Z的浓度相等 D.X、Y、Z的分子个数比为3:1:2
18.在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过
程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A、0.02 mol/(L•min) B、1.8mol/(L•min) C、1.2 mol/(L•min) D、0.18 mol/(L•min)
19.下列反应既属于氧化还原反应,又是吸热反应的是 ( )
A.锌粒与稀硫酸的反应 B.灼热的木炭与COz反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
20.下列叙述正确的是 ( )
A.化学反应除了生成新的物质外,还伴随着能量的变化 B.物质燃烧不一定是放热反应
C.放热的化学反应不需要加热就能发生 D.吸热反应不加热就不会发生
![]() 二、填空题
二、填空题
21. 14CO2与碳在高温条件下发生反应:14CO2+C 2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
22. 将镁条投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 ,一定时间后反应速率逐渐减慢,其原因是 。
23. 用铜、银与硝酸银设计一个原电池,此电池的负极是 ,负极的电极反应式是 。
24. 用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下)。导线中通过 mol电子。
25. 下列反应中,属于放热反应的是 ,属于吸热反应的是 。①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
三、计算题
![]() 26. 可逆反应4A(g)+5B(g) 4C(g)+6D(g),取4molA和5molB置于容积为5L的容器中,20s后,测得容器内A的浓度为0.4mol/L。则此时B、C的浓度是多少?若以物质D来表示这段时间的反应速率应为多少?
26. 可逆反应4A(g)+5B(g) 4C(g)+6D(g),取4molA和5molB置于容积为5L的容器中,20s后,测得容器内A的浓度为0.4mol/L。则此时B、C的浓度是多少?若以物质D来表示这段时间的反应速率应为多少?
![]() 27.恒温下,将a mol N2与b mol
H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) 2NH3(g)
27.恒温下,将a mol N2与b mol
H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) 2NH3(g)
(1)若反应某时刻t时,n t (N2) = 13 mol,n t (NH3) = 6 mol,则a =__________mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),
n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
第二章:化学反应与能量(检测) 参考答案
一、选择题
1.C 2.AC 3.D 4.AC 5.B 6.C 7.C 8.AD 9.B 10D 11.B 12.D 13.D 14.A 15.D 16.B 17.A 18.C 19.B 20.A
二、填空题
21、吸; 14CO2、14CO、14C(需注明质量数)
22、该反应放热,体系温度升高,反应速率加快; 盐酸浓度不断减小,反应速率减缓。
23、铜;Cu-2e-=Cu2+
24、1.12L;0.1mol
25、②③④⑤⑥ ; ①
三、计算题
26、C(B)=0.5mol/L; C(C)=0.4mol/L; v(D)=0.03mol/(L·s)
27、(1)16 mol;(2)8 mol;(3)5∶4;(4)2∶3;(5)1∶2;(6)3∶3∶2;