高一化学上学期期末试卷
命题人:郑宝顺
审题人:蔡景东
说明:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间120分钟。
2.请将全部答案填到答题卷中。
3.本卷可能用到的相对原子质量:Mg-24;Cu-64;Al-27;Fe-56;H-1;C-12; O-16; C1-35.5;N-14;Na-23
第Ⅰ卷 (选择题 共44分)
在下列各题的四个选项中均只有一个是符合题目要求的。
1.下列物质不属于合金的是
A、硬铝 B、水银
C、不锈钢 D、黄铜
2.形成酸雨的主要原因是
A.未经处理的工业废水任意排放
B.大气中二氧化碳含量增多
C.工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属
D.汽车排放的尾气
3.最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种粒子是由3个氢原子核(只有质子)和2个电子构成。对于这种粒子,下列说法中正确的是
A.是氢的一种新的单质 B.是氢的一种新的同位素
C.它的组成可用H3表示 D.它比一个普通H2分子多一个氢原子核
4.下列物质间的反应没有明显反应现象的是
A.常温下,浓硝酸、浓硫酸使铁和铝发生钝化
B.二氧化硫气体分别通入氯水、品红溶液中
C.用玻璃棒分别蘸取浓盐酸和浓氨水并互相靠近
D.将氨气通入滴有酚酞试液中
5.少量钠应保存在
A.密闭容器中 B.煤油中
C.水中 D.四氯化碳中
6.下列化合物中,不能由单质直接化合得到的是
A.NO B.Na2O2
C.FeCl2 D.CuCl2
7.下列各组物质反应能生成氢气的是
A.铁与稀硝酸 B.炭与水蒸气
C.铁与浓硫酸 D.次氯酸见光分解
8.下列物质是属于非电解质的是
A NH3 B (NH4)2SO4
C Cl2 D CH3COOH
9.下列变化中,必须加入氧化剂才能发生的是
A.HC1→NaCl B.SO2→S
C.Na→Na2O2 D.NaHCO3→CO2
10.下列仪器常用于物质分离的是
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥容量瓶
A.①③④ B.①②⑥
C.①③⑤ D.①③⑥
11.石英沙(主要成分SiO2)是一种常见工业原料,其中常混有少量碳酸钙。要除去石英沙中的少量碳酸钙,应采用的方法是
A.用稀硫酸溶解后过滤分离
B.用酒精灯加热
C.用水溶解后过滤分离
D.用稀盐酸溶解后过滤分离
12.在等体积的NaC1、MgCl2、A1Cl3三种溶液中,分别加入等体积且等物质的量量浓度的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为
A.1:2:3 B.3:2:1
C.1:1:1 D.6:3:2
13.下列反应中气体只作氧化剂的是
A.C12通入水中 B.C12通入NaBr溶波中
C.H2与灼热的CuO反应 D.NO2通入水中
14.某无色透明溶液,在酸性环境下能大量共存的离子组是
A.Na+ K+ SiO32- Cl- B.Na+ SO42- HCO3- C1-
C.K+ MnO4- NO3- Fe2+ D.Mg2+ Cl- NH4+ SO42-
15.跟100mL 0.1mol·L-1(NH4)2SO4溶液中的NH4+浓度相同的是
A.0.2mol·L-1 NH4Cl溶液200mL
B.0.2mol·L-1氨水溶液100mL
C.0.1mol·L-1NH4NO3溶液100mL
D.0.2mol·L-1(NH4)2SO4溶液50mL
16.设NA代表阿伏加德罗常数,下列说法正确的是
A.23g金属钠变为钠离子时失去的电子数为NA
B.18g水所含的电子数目为NA
C.在常温常压下11.2L氯气所含的原子数目为NA
D.常温常压下32g氧气所含的原子数目为NA
17.下列有关碳酸钠和碳酸氢钠的说法不正确的是
A、在水中的溶解度:碳酸钠>碳酸氢钠
B、热稳定性:碳酸钠>碳酸氢钠
C、等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,前者产生二氧化碳少
D、足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生二氧化碳一样多
18.能正确表示下列化学反应的离子方程式是
A.氢氧化钡溶液与盐酸的反应OH- +H+ ═H2O
B.澄清的石灰水与稀盐酸反应 Ca(OH)2 +2 H+ ═Ca2+ + 2 H2O
C.铜片插入硝酸银溶液中 Cu + Ag+ ═Cu2++ Ag
D.碳酸钙溶于稀盐酸中CO32- + 2 H+ ═H2O + CO2↑
19.有10.8 g铝粉溶于500mL 4mol·L-1的盐酸中,再加入2mol·L-1的氢氧化钠溶液,若要使产生的沉淀的质量最大,则需加入的氢氧化钠溶液的体积为
A.100ml B.500mL C.1000mL D.1500mL
20.下列说法或操作:
①做实验时可用手直接拿取金属钠
②用托盘天平称量50.56gKCl
③用酒精可以从饱和碘水中萃取碘
④让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路"
⑤从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可用结晶的方法
其中正确的是
A.①②③④⑤ B.②④⑤
C.②③④ D.④⑤
21.等质量的CH4和NH3相比较,下列结论错误的是
A.它们的分子个数之比为17:16
B.它们的原子个数之比为17:16
C.它们的氢原子个数之比为17:12
D.同温同压下两种气体的体积之比是17:16
22.Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合后通入品红和BaCl2的混合溶液,能观察到的现象是:
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A、①② B、①③ C、②③ D、②④
答题卷
(高一化学) 总成绩
请将选择题答案填入下表中(每题2分,共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
第Ⅱ卷 (非选择题 共56分)
23.(7分)印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下:
Cu + 2FeCl3 ═ CuCl2 + 2FeCl2
(1)请在上式中标出电子转移的方向和数目
(2)上述反应中的氧化剂是:
(3)写出FeCl3的电离方程式: 。
(4)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是 (填序号)
A.氯气 B.铁
C.双氧水 D.稀硫酸
24.(9分)欲除去下列物质中所含的杂质(括号内为杂质),请将选用的试剂或分离方法填在题后的横线上,并写出有关反应的化学方程式。
(1)NaHCO3 (Na2CO3);除杂试剂或分离方法
反应的化学方程式
(2)SiO2(Al2O3);除杂试剂或分离方法
反应的化学方程式
(3)NaCl(NH4Cl) ;除杂试剂或分离方法
反应的化学方程式
25.(7分)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等阳离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有的阳离子有 ,一定不含的阳离子有 ,还有一种阳离子不能确定是否存在,要检验这种阳离子的实验方法是 (填写实验名称),观察到的现象是 。
26.(7分)根据下图所示实验回答下列问题:
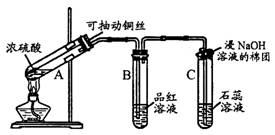
(l)试管A中发生反应的化学方程式是
________________________________________________________________
试管C口部的棉团中发生反应的离子方程式是
________________________________________________________________
(2)试管B中的实验现象是______________________________________
若将该试管中反应后的溶液加热,可以观察到试管B中的实验现象是
______________________________________________________
通过试管C中的实验现象,可以证明SO2是 氧化物。
(填“酸性”,“碱性”或“两性” )
27.(6分)有硫酸、硫酸铁、硫酸亚铁混合溶液1L中,其中含SO42-的浓度6mol/L;
则含有的阳离子有 ,
已知各种阳离子的物质的量相同,则其浓度为 mol/L;
此溶液理论上可溶解铁粉的质量为 。
28.(12分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
|
|
|
![]()
![]()
![]()
![]()
![]()
![]() ②
②
|
水 金属B 金属C
![]() ①
③
④
①
③
④
|
|
|
![]()
![]()
![]()
![]() ⑥
⑤
⑥
⑤
![]()
![]()
|
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A 、 B 、 C 、乙
(2)写出下列反应化学方程式:
反应①
反应③
(3)写出下列反应离子方程式:
反应④
反应⑥
29.(8分)将一定量铜与足量浓硝酸充分反应,可以得到6.72L NO2气体(气体体积在标准状况下测定)。
(1)写出铜与浓硝酸反应化学方程式
(2)若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是多少?
(3)若改用排水法收集气体,则可收集到气体的体积为多少?
答题卷
(高一化学)
请将选择题答案填入下表中(每题2分,共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | B | C | D | A | B | C | B | A | C | C | D |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | D | B | D | A | A | D | A | C | D | B | C |
第Ⅱ卷 (非选择题 共56分)
23.(7分)(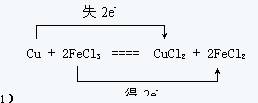
(2)FeCl3(3)FeCl3 ==Fe3+ + 3 Cl-(4)AC
24.(9分)(1)CO2,H2O ;Na2CO3 + CO2 + H2O == 2 NaHCO3
(2)NaOH溶液;Al2O3 + 2NaOH == 2NaAlO2 + H2O
(3)方法一:加热;NH4Cl == NH3 ↑+HCl↑(条件:加热)
方法二:NaOH并加热;NH4Cl + NaOH = NH3 ↑+ H2O +NaCl(条件:加热)
25.(7分)一定含有的阳离子有Ag+、Ba2+、NH4+;一定不含的阳离子有Fe3+;
焰色反应;火焰呈紫色(透过蓝色钴玻璃)
26. (7分)(l)Cu + 2H2SO4 = CuSO4 + SO2 ↑+ 2H2O(条件:加热)
SO2 + 2OH- = SO32- + H2O
(2)品红褪色;品红又重新恢复红色;酸性
27.(6分)H+,Fe2+,Fe3+ ; 2 ;112 g
28.(12分)(1)A:Na、 B :Al、 C :Fe、乙:Cl2
(2)反应①2Na + 2H2O = 2NaOH + H2 ↑
反应③2NaOH + 2H2O + 2 Al =2NaAlO2 + 3H2 ↑
(3)反应④Fe + 2H+ =Fe2+ + H2 ↑ 反应⑥Fe3+ + 3OH- = Fe(OH)3↓
29.(8分)(1)Cu + 4HNO3(浓) = 3Cu(NO3)2 + 2NO2 ↑+ 2H2O
(2)1.5mol/L(3)2.24L