高一化学上学期段考试题
高一化学(第一套)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 K-39 Ca-40
第I卷(选择题,共72分)
一.选择题(每小题只有一个选项符合题意,每小题4分,共72分)
1.关于摩尔的叙述中正确的是
A.摩尔是物质质量的单位
B.摩尔是物质数量的单位
C.摩尔既表示物质微粒数量,又表示物质质量,是具有双重意义的单位
D.摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
2.下列反应中属于氧化还原反应的是
A.CO2+H2O==H2CO3 B.CO2+C![]() 2CO
2CO
C.CaCO3+2HCl==CaCl2+H2O+CO2↑ D.H2CO3==CO2↑+H2O
3.下列物质是强电解质的是
A.NaCl溶液 B.BaSO4 C.CH3COOH D.氨水
4.Na着火后,用以灭火的物质是
A.H2O B.煤油 C.泡沫灭火器 D.砂土
5.下列微粒中,没有氧化性的是
A.Cl- B.H+ C.Cl2 D.HClO
6.下列关于铯(Cs)及其化合物的叙述不正确的是
A. 无水硫酸铯的化学式为Cs2SO4,易溶于水
B. 碳酸铯加热难分解
C. 在Na、K、Rb、Cs中,Cs熔点最高,密度最大
D. CsOH是离子化合物,易溶于水,碱性比NaOH强
7.下列变化中,物质被氧化的是
A.CaO→Ca(OH)2 B.Cu2+→Cu C.Fe2+→Fe3+ D.CO2→CO
8.下列各组离子在溶液中可大量共存的是
A.K+,HCO3-,CO32-,Na+ B.HCO3-,Ba2+,NH4+,OH-,
C.HCO3-,SO42-,K+, H + D.Ag+,NO3-,Na+,Cl-
9.能用H++OH- H2O来表示的化学反应是
A.固体Cu(OH)2和H2SO4反应 B.澄清石灰水和HNO3溶液反应
C.KOH溶液和醋酸溶液反应 D.Ba(OH)2和H2SO4溶液反应
10.下列说法正确的是:
A. 需要加热才能发生的反应一定是吸热反应
B. 放热的反应在常温下一定很容易发生
C. 反应是放热的还是吸热的必须看反应物和生成物所具有的总能量的相对大小
D. 吸热反应在常温下一定不能发生
11.能用来鉴别Na2CO3固体与K2CO3固体的方法是
A.加稀盐酸 B.加NaOH溶液 C.焰色反应 D.加热
12.黑火药发生爆炸的反应中:S+2KNO3+3C==K2S+N2↑+3CO2↑,被还原的元素是
A.只有N B.只有S C.只有C D.N和S
13.下列离子方程式书写正确的是
A.水中加入过氧化钠:2Na2O2+2H2O==4Na+ +4OH-+O2↑
B.碳酸氢钙溶液中加入盐酸:CO32-+2H+==CO2↑+ H2O
C.氢氧化钡溶液与硫酸溶液反应:Ba2++ OH-+H++SO42-==BaSO4↓+H2O
D.碳酸钙与硝酸反应:CO32-+2H+== H2O+CO2↑
14.对2Na2O2+2CO2==2Na2CO3+O2↑下列说法正确的是
A.是氧化还原反应,Na2O2是氧化剂,CO2是还原剂
B.是氧化还原反应,CO2是氧化剂,Na2O2是还原剂
C.不是氧化还原反应,是碱性氧化和酸性氧化物反应
D.是氧化还原反应,Na2O2既是氧化剂,又是还原剂
15.下列说法中正确的是
A.Na2CO3 能与HCl反应而NaHCO3不能
B.NaHCO3比Na2CO3易溶于水
C.NaHCO3的热稳定性比Na2CO3差
D.Na2CO3可与石灰水反应而NaHCO3不能
16.在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子个数比是
A.1:2 B.2:1 C.1:1 D.3:2
17.下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O ② 4HCl(g)+O2
MnCl2+Cl2↑+2H2O ② 4HCl(g)+O2![]() 2Cl2+2H2O(g)
2Cl2+2H2O(g)
③2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
则三个方法中的三种氧化剂由强到弱的顺序是
A.O2、MnO2、KMnO4 B.KMnO4 、MnO2 、O2
C.MnO2 、KMnO4、 O2 D.O2 、KMnO4 、MnO2
18.在100℃时,3.6g CO和H2的混合气体与足量的氧气反应后通入装有足量Na2O2的反应管充分反应,已知CO和H2的质量比为5:1,则反应管增重
A.5.6 g B. 1.6 g C.3.2 g D.3.6 g
第II卷(非选择题,共78分)
二、填空题(本题包括3小题,共22分)
19.(10分)(1)0.5 mol H2O的质量为 ,其中约含有 个水分子,共有 个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 ,含有原子数目最多的是 。
20.(6分)写出下列反应的离子方程式:
(1)氧化铜投入盐酸中: 。
(2)钠投入硫酸铜溶液中:__________________________________________________。
21.(6分)(1)向氢氧化钡溶液中逐滴加入硫酸溶液至过量,其溶液的导电性的变化是 。
A. 由弱变强 B. 由强变弱 C. 由强变弱再变强 D. 由弱变强再变弱
(2)室温时,将下列物质各5g,把其投入95g水中,充分搅拌后,所得溶液中溶质的质量分数最小的是 。(填编号)
A.CaO B.Na2O C.Na D.NaOH
三、实验题(本题包括2小题,共22分)
22.(8分)写出下列除杂操作所需试剂,并写出涉及的反应的离子方程式:(括号内为杂质)
(1) Cl-(CO32-)试剂 ,离子方程式 。
(2) 碳酸氢钠溶液(碳酸钠)试剂 ,离子方程式 。
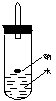
23.(14分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成
![]() H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们
H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们
设计了如右装置图,请回答下列问题:
⑴写出Na与H2O反应的离子方程式 。
⑵在点燃H2之前必须先进行 ,方法是 。
⑶实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是 。
⑷实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。
![]()
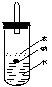
原实验 改进后实验
在改进后的实验中H2的生成速率减慢。原因是 。(填编号)
A. 加了苯使得水不纯,从而减慢H2的生成速率。
B. 钠落在苯水交界处,产生的H2使钠浮起又回落,可减慢Na与H2O反应速度。
C. 受到苯的阻碍,钠在水面游动的速率减慢,可减慢Na与H2O反应速度。
四、推断题(本题包括2小题,共16分)
24. (10分)有一白色粉末,其中可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2。(1)取少量此白色粉末投入水中,得无色溶液和白色不溶物。(2)继续往其中加入足量稀硝酸,白色不溶物消失,并有气泡产生。(3)取少量(2)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。根据上述实验现象判断:该白色固体中一定含有 ,一定不含有 ,可能含有 。(多选扣分)
25.(6分)下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
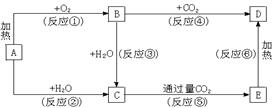
请填写下列空白:
(1)以上反应中,属于氧化还原反应的有____________________。(填写编号)
(2)写出C→E反应的化学方程式 。
(3)写出E溶液与足量澄清石灰水反应的离子方程式 。
五、计算题(本题包括2小题,共18分)
26.(6分)在反应2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O中。
(1)试问该反应中转移电子总数是多少e-?被氧化和未被氧化的HCl的质量之比是多少?
(2)若有7.3gHCl被氧化,产生Cl2的质量是多少g?
27.(12分)有Na2CO3 、NaHCO3、NaCl的固体混和物4g,现将它们加热到质量不再减轻,冷却后称得质量为3.38g。在残留固体中加入过量的盐酸产生CO2,该气体经干燥后通过装有足量Na2O2的玻璃管,测得玻璃管中固体的质量增加了0.56g。
求(1)原混和物中NaHCO3的质量;
(2)加热后新增加的Na2CO3的质量;
(3)残留固体与盐酸反应产生CO2的质量;
(4)原混和物中NaCl的质量。
答题卷
高一化学(第一套)
19.(1) , , 。(2) , 。
20.(1) 。
(2) 。
21.(1) (2)
22.(1) , 。
(2) , 。
23.(1) 。(2) ,
。
(3) 。
(4) 。
24. , , 。
25.(1) 。
(2) 。
(3) 。
26.
27.
答案
高一化学
1. D 2.B 3.B 4.D 5.A 6.C 7.C 8.A 9.B 10.C
11.C 12.D 13.A 14.D 15.C 16.A 17.B 18.D
19.(1)9g , 3.01×1023, 9.03×1023 (2)CO2 , NH3
20.(1)CuO+2H+==Cu2++H2O(2)2Na + Cu2++2H2O==2Na+ + Cu(O H)2↓+H2↑
21.(1)C (2)D
22.(1)盐酸,2H++ CO32-=H2O+CO2↑。(2)CO2,H2O+CO2+CO32-=2HCO3-
23.(1)2Na+2H2O=2Na++2OH-+H2↑。
(2)验纯,用向下排气法收集一试管氢气,用拇指堵住,移近火焰,移开拇指点火。若听到轻微的“扑”声,则表明H2纯净。
(3)较多的钠与水反应放出大量的热,使试管内H2与O2的混和气点燃而爆炸。
(4)B
24.CaCO3 Na2SO4 ,CuSO4 BaCl2 ,KNO3
25.(1)①②③④
(2)NaOH+CO2=NaHCO3(3)HCO3-+Ca2++OH-=CaCO3↓+H2O
26.(1)转移电子总数:10e-, m(被氧化的HCl):m(未被氧化的HCl)=5:3
(2)10HCl(被氧化)~5 Cl2
10×36.5g 5×71g
7.3g m(Cl2) 解得m(Cl2)=7.1g 答:略
27.解:设产生CO2的质量为x,NaHCO3的质量为y,新增加的Na2CO3的质量为z,加热后固体混合物中Na2CO3的质量为a。
(1)![]()
88g 56g
x 0.56g
![]()
(2)![]()
168g 106g 62g
y z 0.62g
(3)![]()
106g 44g
a 0.88g
106g:44g=a:0.88g a=2.12g
则原混合物中Na2CO3为:2.12g-1.06g=1.06g
NaCl为:4g-1.68g-1.06g=1.26g 答:略