高一化学上学期第二学段考试试卷
高一化学(必修1)
命题人:高一备课组 审核人:刘梅芳 2008-1-18
本卷可能用到的相对原子质量:C:12 H:1 N:14 Cu:64 O:16 Fe:56 S:32 Si:28 Na:23 Mg:24 Al:27 Ba:137 K:39 Zn:65 Cl:35.5
一、选择题(每小题只有一个选项符合题意,每小题2分,共46分)
1.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是( )
A. 所得分散系不稳定 B.能全部透过半透膜
C.不能透过滤纸 D.有丁达尔效应
2.环境保护是我国的一项基本国策。污染已成为人类社会面临的重大威胁,为了减少酸雨的产生可采取的措施是①用煤做燃料②把工厂烟囱造高③化石燃料脱硫④在已酸化的土壤中加石灰⑤开发新能源( )
A.③⑤ B.①③④⑤ C.①②③ D.②③④⑤
3、互联网上报道:“目前世界上有近20亿人患有缺铁性贫血,影响着人的身体健康和智力,对孕妇和儿童危害尤其严重”。我国政府已启动了“酱油补铁工程”。这里的铁是指( )
A. 氧化铁 B. 四氧化三铁
C. 铁单质 D. 铁元素
4、下列物质中,不属于合金的是( )
A.硬铝 B.黄铜 C.钢铁 D.水银
5、氯仿(CHCl3,非电解质)在空气中能发生缓慢氧化,生成剧毒物质光气(COCl2,非电解质),化学方程式为2CHCl3+O2==2COCl2+2HCl;检验氯仿是否被氧化应选用的试剂是( )
A、水 B、酚酞溶液 C、NaOH溶液 D、硝酸酸化的硝酸银溶液
6.除去镁粉中的少量铝粉,可选用( )
A、硫酸 B、氨水 C、盐酸 D、氢氧化钠溶液
7.向浓盐酸中滴加浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因是( )
A.浓H2SO4具有脱水性 B.浓H2SO4具有吸水性
C.盐酸具有挥发性 D.气体溶质的溶解度随温度升高而降低
8.下列物质能将Fe3+转化为Fe2+的有( )
①新制氯水 ②.铁 ③ 铜 ④稀硫酸
A ①②③ B ③④ C ②③ D ①②③④
9.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,火焰颜色呈黄色的是小苏打
C.等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,前者产生二氧化碳少
D.先将两样品配成溶液,后分别加入石灰水,无白色沉淀生成的是小苏打
10.下列各组物质中,前者为强电解质,后者为弱电解质的是( )
A.硫酸、硫酸镁 B 碳酸、碳酸镁
C 食盐、酒精 D 碳酸氢钠、醋酸
11.下列化合物中,不能通过单质间化合直接制取的是( )
A.Na2O2 B.CuCl2 C.FeCl2 D.FeS
12、许多元素有多种核素,且自然界中各种核素都有固定的原子分数。如氧元素存在18O、17O、16O三种核素,氢元素有1H、2H、3H三种核素。请你估计,16O和1H、2H三种核素最多构成水分子的种数为( )
A.2 B.3 C.1 D.4
13.无色透明的酸性溶液中能大量共存离子组是( )
A.AlO2-、Na+、SO42-、NO3- B.K+、Na+、Cl-、SO32-
C.K+、MnO4-、NH4+、NO3- D.Na+、K+、Mg2+、SO42-
14.下列离子方程式书写正确的是 ( )
A.铁粉投入到盐酸中:2Fe+6H+=2Fe3++3H2↑
B.Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O
C.澄清的石灰水与稀盐酸反应 Ca(OH)2 +2 H+ ═ Ca2+ + 2 H2O
D.硫酸与Ba(OH)2溶液反应: H++OH-=H2O
15.NaH与水反应的化学方程式为NaH+H2O == NaOH+H2↑,在该反应中H2O ( )
A、是氧化剂 B、是还原剂
C、既是氧化剂又是还原剂 D、既不是氧化剂又不是还原剂
16、设NA为阿伏加德罗常数,下述正确的是 ( )
A.64g二氧化硫含有原子数为3NA
B.1L 1mol/L的氯化钠溶液中,所含离子数为NA
C.标准状况下,11.2L水所含分子数为0.5 NA
D.在反应中,1mol镁转化为Mg2+后失去的电子数为NA
17、a mol O2气体和a mol O3气体相比较,下列叙述一定正确的是 ( )
A.体积相同 B.质量相等 C.原子数相等 D.分子数相等
18、 适量下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是( )
A、碘水 B、溴化钠溶液 C、氯水 D、溴水
19、铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法不正确的是( )
A. 铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B. 常温下不与任何酸、碱反应
C.铝元素在地壳中的含量高,储量丰富
D.工业上可以用电解法冶炼铝
20.科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是 ( )
A.自然界中硅元素的含量最丰富 B.自然界中存在大量单质硅
C.高纯度的硅被用于制作计算机芯片 D.光导纤维的主要成分是Si
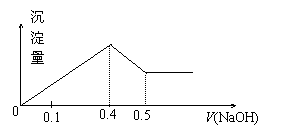 21.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
21.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
A.1:3 B.2:3
C.6:1 D.3:1
22.将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.24 L(标准状况),原混合物的质量可能是 ( )
A. 1.8 g B.6.5 g C.3 g D.10 g
23.下列反应中,不能用离子方程式Ba2++SO42—=BaSO4↓来表示的是( )
A.稀硫酸溶液与硝酸钡溶液反应
B.硫酸钾溶液与氯化钡溶液反应
C.稀硫酸溶液与氢氧化钡溶液反应
D.硫酸钠溶液与硝酸钡溶液反应
二、填空题(共44分)
24.(10分)实验室配制0.5mol·L-1的KCl溶液500mL,有以下仪器:
①烧杯 ②胶头滴管 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒
⑥托盘天平(带砝码) ⑦酒精灯 ⑧量筒
(1)配制时,称量时必须使用的仪器有 (填代号)
(2)该实验两次用到玻璃棒,其作用分别是 、
(3)配制时一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④转移 ⑤洗涤
⑥定容 ⑦摇匀(要用到两次) ⑧冷却
其正确的操作顺序为②①③ ⑦⑥
(4)试计算应称取的KCl固体的质量为 g。在定容时视线应
25、(12分)氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠。其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅、聚氯乙烯、氯苯等。
(1)写出氯碱工业中通过电解饱和食盐水获得重要的化工原料氯气的离子方程式
(2)工业上可用氯气和石灰乳为原料制造漂白粉,写出该反应的化学方程式 。
(3)工业上生产半导体材料硅的流程如下:
 |
①写出在制备粗硅时反应的化学方程式_____________________________,在该反应的化学方程式上标出电子的转移方向和数目。此反应中焦炭的作用是____________。(填“氧化剂”或“还原剂”)
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点,难挥发性杂质,必须进行分离提纯。其提纯方法为____________。(填序号)
A.蒸馏 B.过滤
C.萃取 D.结晶
③由四氯化硅通入氢气得到高纯硅和氯化氢气体,写出该反应的化学方程式:
________________________________________________________________________。
26.(12分)化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,化学实验室产生的废液必须经处理后才能排放。某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了下列方案对废液进行处理:

(1)废液经操作①得到的沉淀中含有的金属单质是 ;
写出操作①的反应离子方程式 ; ; 。
(2)在操作②中观察到的实验现象是
(3)操作③中发生主要反应的离子方程式为
27、(10分)为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:
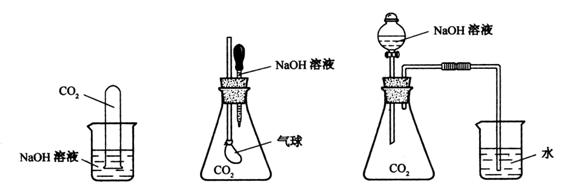 (甲)
(乙)
(丙)
(甲)
(乙)
(丙)
(1)请写出CO2与过量的NaOH发生反应的化学方程式: 。
(2)选择任意一种实验装置,简述预计出现的实验现象,解释产生该实验现象的原因。你选择的实验装置是 ,实验现象是 。 解释产生该实验现象的原因 。
(3)甲、乙、丙同学设计的三个方案中,有一个方案在实际操作中可行性和安全性存在问题,该方案是 。(填甲、乙或丙)
(4)请设计一个实验检验生成的产物中含有Na2CO3。(简述所用试剂、实验现象和结论。)
四、计算题(两小题共10分)
28.(6分)SO2是一种酸性氧化物,能与氢氧化钠溶液反应。反应产物与反应物的量有关,当SO2过量时,生成NaHSO3,当氢氧化钠过量时,生成Na2SO3。
(1)请写出上述反应的化学方程式。
(2)某硫酸厂每天排放1.0×104m3(标准状况)尾气,其中含0.2%(体积分数)的SO2,现欲用2.0mol/L氢氧化钠溶液进行处理,每天至少需氢氧化钠溶液多少升?
(注:1L=1dm3)
29.(4分)(1)某金属氯化物MCl2 40.5 g,含有0.600mol Cl-,则该氯化物的摩尔质量为 ,金属M的相对原子质量为 。
(2)、生物上用高速离心机分离细胞各组分时需要使用蔗糖(C12H22O11)溶液。若某蔗糖溶液的物质的量浓度为3.20mol·L-1,那么 升这样的溶液含137g蔗糖?
五、附加题(两小题共10分。友情提示:此题为高一(1)同学必做,欢迎其他班同学挑战)
30.(2分)向一定量的 FeO、Fe、Fe3O4 和Fe2O3的混合物中加入1mol·L-1的盐酸200ml,恰好使混合物完全溶解,放出224ml(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同的质量的此混合物,能得到铁的质量
是 g?
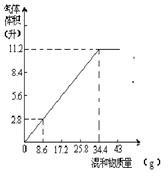 31.(8分)在100ml NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应。右图表示加入的混合物质量和产生的气体体积(标准状况)的关系,试计算:
31.(8分)在100ml NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应。右图表示加入的混合物质量和产生的气体体积(标准状况)的关系,试计算:
(1)NaOH溶液的物质的量浓度 。
(2)当NaOH溶液的体积为140mL,固体混合物质量是51.6g时,充分反应后,生成气体的体积为 。
(3)当NaOH溶液体积为180mL时,固体混和物的质量为51.6g时,充分反应后,生成气体的体积为 。
答案
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | D | A | D | B | D | D | A | C | C | D | C |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 |
| B | D | B | A | A | D | B | B | C | C | A | C |
24.(10分)(1)①②④⑤⑥ (2)搅拌(加速溶解)(1分)、引流(1分) (
3)⑧④⑤ ⑦
|
25、(12分)(1)2 Cl- + 2H2O == 2OH- + H2↑+ Cl2↑
|
|
(3)① SiO2 + 2C == Si + 2CO↑ 略 还原剂(1分)② A ③SiCl4 + 2 H2==== Si + 4 HCl
(电子转移1分,其余各2分)
26.(1)Cu 、Ag Fe+Cu2+=Cu+Fe2+、 Fe+2Ag+=2Ag+Fe2+、 Fe+2Fe3+=3Fe2+
(2)溶液由浅绿色变成黄色(3)Fe3++3OH-=Fe(OH)3↓(每格2分)。
27、(10分)(1)CO2 + 2NaOH ===Na2CO3 + H2O (2分)
(2)甲 现象:试管内液面上升,烧杯内的液面下降
原因:二氧化碳和氢氧化钠溶液反应,使试管内气体压强减小,液体被压入试管中
选 乙 现象:气球胀大。 原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压使气球胀大
选 丙 现象:烧杯内的水流入锥形瓶中。 原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压将液体压入锥形瓶 (现象和原因各2分)
(3)甲 (2分)
(4)取少量试液于试管中,滴加氯化钡或氯化钙溶液,若有白色沉淀生成,可证明有Na2CO3存在。(其他合理的答案均可)(2分)
28.(1)NaOH+SO2==NaHSO3 (1分) 2NaOH + SO2==Na2SO3+H2O(1分)
(2)446.4L(4分)
29.(1)135、64(每个1分)。(2)0.125(2分)
30.5.6(2分)
31.由图可见:34.4g混合物和100mLNaOH溶液恰好完全反应。
n(NaOH)=n(NH3)=![]() =0.5mol
=0.5mol
c(NaOH)=![]() =
=![]() =
5.00mol/L
=
5.00mol/L
(2)V(NaOH)=140mL完全反应所需固体质量
![]() =
=48.16g<51.6g,
=
=48.16g<51.6g,
因固体过量,所以
V(g)=22.4L·mol-1×5mol·L-1×0.14L=15.68L
(3)V(NaOH)=180mL完全反应所需固体质量
= ![]() =61.92g>51.6g,故NaOH过量,固体51.6g完全反应,
=61.92g>51.6g,故NaOH过量,固体51.6g完全反应,![]() =
=![]()
V(g)=16.8L
【答案】:(1)5.00mol/L (2)15.68L (3)16.8L。