高一化学下学期第二章单元测试题
一、选择题(本题包括22小题,每小题3分,共66分,每小题只有一个选项符合题意)
1.向2L密闭容器里充入2 mol M和一定量的N,发生如下反应:M(g)+N(g)![]() E(g);当反应进行到2min时,测知M的浓度为0.6 mol·L-1;反应进行到4min时,密闭容器中M的物质的量浓度为
( )
E(g);当反应进行到2min时,测知M的浓度为0.6 mol·L-1;反应进行到4min时,密闭容器中M的物质的量浓度为
( )
A.等于0.2 mol·L-1 B.小于0.2 mol·L-1 C.大于0.2 mol·L-1 D.无法确定
2.有如下两个反应:①E(g)![]() M(g)+N(g)②A(g)
M(g)+N(g)②A(g)![]() C(g)+B(g),起始时c(E)> c(A),且①的反应温度高于②(其他条件不变),则两反应的速率大小为: ( )
C(g)+B(g),起始时c(E)> c(A),且①的反应温度高于②(其他条件不变),则两反应的速率大小为: ( )
A.①>② B.①< ② C.①= ② D.无法确定
3.根据化学反应的实质是旧化学键断裂、新化学键生成这一理论,下列变化不属于化学变化的是
A.生石灰变成熟石灰 B.水在高温下变成水蒸气 C.石墨转变为金刚石 D.钠投入水中
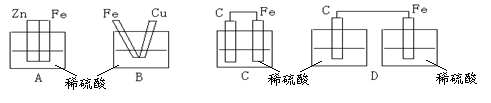
4.下图各装置中,不能构成原电池的是( )
5.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会变冷。该化学物质是 ( )
A.氯化钠 B.固体硝酸铵 C.固体氢氧化钠 D.生石灰
6.据最新《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍适用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥的是 ( )
A.硅便于运输、贮存,从安全的角度考虑,硅是最安全的燃料
B.自然界中存在大量的单质硅
C.硅燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制
D.自然界中硅易开采,且可再生
7.银锌纽扣电池,其电池的电极反应式为Zn+ Ag2O+H2O =Zn(OH)2+2Ag。据此判断氧化银是
A.负极,并被氧化 B.正极,并被还原 C.负极,并被还原 D.正极,并被氧化
8.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷(C2H6)和氧气,其电极反应式为: C2H6+18OH--14e-=2CO32-+12H2O,
2H2O+O2+4e-=4OH-,有关此电池的推断不正确的是
A.电池工作过程中,溶液的pH值逐渐减小 B.通乙烷的电极为负极
C.正极与负极上参加反应的气体的物质的量之比为2 :7 D.负极发生氧化反应
9.将1mol N2和3 mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1 mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率。① v(N2) = 0.15 mol/(L·min) ② v(N2) = 1.05 mol/(L·min) ③ v(NH3) = 0.30 mol/(L·min) 其中正确的是
A、①② B、②③ C、①③ D、①②③
 10.已知可逆反应2SO2 + O2
10.已知可逆反应2SO2 + O2 ![]() 2SO3,当生成2 mol SO3时放出热量为Q,
2SO3,当生成2 mol SO3时放出热量为Q,
![]() 现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则
现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则
A、Q1 = Q B、Q1 < Q C、2Q1 > Q D、无法判断
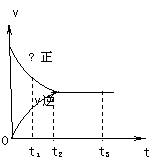
11.右图是可逆反应X2 + 3Y2 ![]() 2Z2 在反应过程中的反应速率(v)
2Z2 在反应过程中的反应速率(v)
与时间(t)的关系曲线,下列叙述正确的是
A、t1时,只有正方向反应 B、t3时,反应到达限度
C、t2- t3,反应不再发生 D、t2- t3,各物质的浓度不再发生变化
12.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
A、Q1 < Q2 B、石墨与金刚石完全燃烧,生成的二氧化碳一样多
C、石墨不如金刚石稳定 D、石墨具有的能量比金刚石低
13.100 mL 6 mol·L-1 H2SO4 跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
A.碳酸钠固体 B.水 C.硫酸铜固体 D.硫酸铵固体
14.氢气在氯气中燃烧产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2KJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.Q1 + Q2 >Q3 B.Q1 + Q2 <2Q3 C. Q1 + Q2 <Q3 D.Q1 + Q2 >2Q3
15.ABCD四种金属.将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,将A、D分别投入等浓度的盐酸中,D比A反应剧烈,将铜浸入B的盐溶液中,无明显现象,若将铜浸入C的盐溶液中,有金属C析出.据此判断这四种金属的活动性由强到弱的顺序是 ( )
A.D>C>A>B B.D>B>A>C C.D>A>B>C D.B>A>D>C
16.已知可逆反应:mA+nB==xC (A,B,C均为气体)在t s内的平均反应速率为:v(A)= a mol/(L·s),v(B)= b mol/(L·s),v(C)= c mol/(L·s)。则x的值为
A bc/n B nc/b C ma/c D ac/m
17.同温同压下,当反应物分解了8%时,总体积也增加8%的是
![]()
![]() A.2NH3(g)
N2(g)+3H2(g)
B.2NO(g) N2(g)+O2(g)
A.2NH3(g)
N2(g)+3H2(g)
B.2NO(g) N2(g)+O2(g)
![]()
![]() C.2N2O5(g)
4NO2(g)+O2(g)
D.2NO2(g) 2NO(g)+O2(g)
C.2N2O5(g)
4NO2(g)+O2(g)
D.2NO2(g) 2NO(g)+O2(g)
18. 如图所示,各烧杯中均盛有海水,铁在其中被腐蚀由快到慢的顺序为 ( )
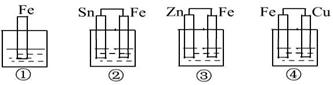
A. ②①③④ B. ④③①② C. ④②①③ D. ③②④①
19.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(气)+B(气)=2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1 ② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1 ③ 2 s 时物质 A 的转化率为70% ④ 2 s 时物质 B 的浓度为 0.7 mol·L-1 , 其中正确的是
A.①③ B. ①④ C. ②③ D. ③④
20.在一定温度下,均能形成单键的A2、B2、AB三种分子有如下反应发生:A2(g)
+ B2(g) ![]() 2AB(g),该反应达到平衡时的标志是
2AB(g),该反应达到平衡时的标志是
A. A2的生成速率与AB的分解速率相等
B.单位时间内生成 2 n mol AB, 同时消耗 n mol A2
C.单位时间内1mol A-A键断裂,同时断裂2 mol A-B
D. A2、B2、AB的浓度不再变化,且A2、B2、AB的分子数之比为1:1:2
21.NO和CO都是汽车尾气中的有害物质, 它们能缓慢地反应生成氮气和二氧化碳,对此反应,下列叙述正确的是: ( )
A.使用适当的催化剂不改变反应速率 B.降低压强能提高反应速率
C.升高温度能提高反应速率 D.改变压强对反应速率无影响
22.已知H+(aq) + OH-(aq) = H2O(l);ΔH = - 57.3 kJ·mol-1。以下四个化学反应方程式:
① H2SO4(aq) +2 NaOH(aq) = Na2SO4(aq) + 2 H2O(l);
② H2SO4(aq) + Ba(OH)2(aq) = BaSO4(s) + 2 H2O(l);
③ HCl(aq) + NH3•H2O(aq) = NH4Cl(aq) + H2O(l);
④ CH3COOH(aq) + NH3•H2O(aq) = CH3COONH4(aq) + H2O(l)。
其中反应热为57.3 kJ·mol-1的是
A.①和② B.③ C.④ D.以上都不对
二.填空题
23.(2分) 14CO2与碳在高温条件下发生反应:14CO2+C
![]() 2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
24.(2分) 用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下)。导线中通过 mol电子。
25.(4分)拆开1mol H—H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2生成NH3 热量(填:吸收或放出) kJ;
理论上,每生成1mol NH3, 热量(填:吸收或放出) kJ;
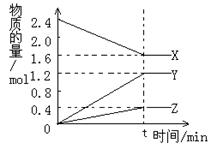 26.(6分),在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如右图。反应在t时到达平衡,依图所示:
26.(6分),在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如右图。反应在t时到达平衡,依图所示:
(1)该反应的化学方程式是 。
(2)反应起始至t,Y的平均反应速率是 。
(3)X的物质的转化率是 。
(4)生活中利用原电池原理生产了各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其主要原因是 。
A、回收利用电池外壳的金属
B、防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
C、防止电池中渗泄的电解液腐蚀其他物品 D、回收其中石墨电极
27、(8分)已知电极材料:铁、铜、银、石墨、锌、铝,电解质溶液:氯化铜溶液、硫酸铁溶液、盐酸。按要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因。
。
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? ,若能,请写出电极反应式,负极 ,
正极 。若不能后面两空不填。
③有M、N两种金属分别与稀盐酸反应,产生氢气速率相近,请设计一个实验证明M、N两种金属的活泼性 。
28.(6分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,原因是
② 哪一段时段的反应速率最小 ,原因是 。
③ 求2 ~ 3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程。
三.计算题
29.(6分)把4 mol N2和8 mol H2置于5 L密闭容器合成氨反应,达到平衡时测得混合气体中含NH3的体积百分比为20%,求:(1)混合气体中含H2的体积百分比;
(2)反应前后容器内的压强比; (3)N2和H2的转化率。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| C | D | B | D | B | B | B | C | C | B | D |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| C | B | B | C | B | A | C | B | C | C | D |
23.吸; 14CO2、14CO、14C(需注明质量数)
24.1.12L;0.1mol
25.放出,92;放出,30.67;放出,46.2
26. (1)2X=3Y+Z (2)0.6/t mol/(l.m) (3)33.3%(4)A
27.在潮湿的空气中,铜与铝接触形成原电池,铝做负极,很快被腐蚀。
28.① 2~3 min ,因该反应是放热反应,此时温度高。(2分)
② 4~5 min ,因为此时H+ 浓度小。(2分).
③ 0.1 mol/L·min(4分)
29. (1)50% (2)6:5 (3) N2的转化率为25%,H2的转化率为37.5%