高一化学下期3月月考试题(2008.3)
时间90分钟 总分100分
一.选择题(每小题只有一个选项符合题意,每小题2分)
1.已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
2.下列物质中,既有离子键,又有共价键的是( )
A.H2O B.CaCl2 C.KOH D.Cl2
3.下列说法中,正确的是( )
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期序数等于原子核外电子层数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
4.下列分子中所有原子都满足最外层为8个电子结构的是( )
A.BF3 B.SiCl4 C.H2O D.PCl5
5.下列叙述错误的是( )
A.使阴、阳离子结合成化合物的静电作用叫做离子键
B.金属元素与非金属元素相化合时一定形成离子键
C.化合物中只要含有离子键就一定属于离子化合物
D.含共价键的化合物不一定是共价化合物
6.下列说法中错误的是( )
A.质量数相同的原子,其化学性质一定相同 B.质子数相同的原子,其核外电子排布也相同
C.金属性越活泼,其原子在反应中越易失去电子 D.非金属性越活泼,其阴离子越难失去电子
7.下列关于1H、2H、3H、H+ 说法正确的是( )
A.化学性质不同的氢原子 B.同一种氢原子 C.氢的四种同位素 D.氢元素的不同微粒
8.下列关于化学键的说法正确的是( )
A.构成单质分子的微粒一定含有共价键 B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子分子中 D.不同元素组成的多原子分子里的化学键一定是极性键
9.下列关于元素周期表的叙述,不正确的是( )
A.ⅡA族中无非金属元素 B.Ⅷ族中所含元素种类最多
C.O族中无金属元素 D.金属元素的种类比非金属元素多
10.短周期元素离子A2╋、B╋、C3━、D━都具有相同电子层结构,则下列叙述正确的是( )
A.原子半径 A>B>D>C B.原子序数 D>C>B>A
C.离子半径 C>D>B>A D.最外层电子数 C>D>A>B
11.同一周期X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是HXO4>H2YO4>H3ZO4,则下列判断
中正确的是( )
A.原子半径X>Y>Z B.非金属性X<Y<Z
C.气态氢化物的稳定性HX>H2Y>H3Z D.阴离子的还原性X—>Y2—> Z3—
12.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数
是(a+b),则A、B两元素形成的化学式最可能表示为( )
A.B3A2 B.BA2 C.A3B2 D.AB2
13.下列说法中不符合科学的是( )
A.可用食醋除去水壶中的水垢
B.CO气体有毒,在生有炉火的居室中多放几盆水可吸收CO
C.用双氧水(H2O2)清洗伤口可以杀菌消毒
D.臭氧层的破坏对人类健康有害
14.意大利科学家用O2— 和O2+制造出了一种新型氧分子O4,下列叙述正确的是( )
A.16O、18O2+都是氧元素的同位素 B.O2、O2+、O4都是O3的同素异形体
C.O4是新型的氧化物 D.制造O4的反应是氧化还原反应
15.下列说法错误的是( )
A.金属性 Rb>K>Mg>Al B.非金属性 As<S<Cl<F
C.稳定性 AsH3>PH3 >H2S>HF D.原子半径 Na>P>O>F
16.X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量为( )
A.(m+n+2)w/m mol B (m-n+2)w/m mol C.(m+n-2)w/m mol D (m-n-2)w/m mol
17.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性且碱性
B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中离子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A.B、A、C、D、E B.E、B、A、C、D C.B、A、E、D、C D. B、A、E、C、D
18.下列指定微粒的个数比为2:1的是 ( )
A.Be2+离子中的质子和电子 B.21H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子 D.BaO2(过氧化钡)固体中的阴离子和阳离子
19.元素R的最高价含氧酸的化学式为HnRO2n-2,则在其气态氢化物中R的化合价为( )
A.12-3n B.3n-12 C.3n D.无法确定
20.下列不能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤
21.居室装修用石材的放射性常用![]() 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中不正确的是( )
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中不正确的是( )
A.一个22688Ra原子中含有138个中子 B.镭的碳酸盐难溶于H2O
C.镭单质与H2O发生剧烈反应,放出H2 D.Ra(OH)2是一种两性氢氧化物
22.A 、B分别为第三、四两周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数。① 若A为ⅡA族,其质量数为X ,则B的质子数为Y;② 若A为ⅣA族,其质子数为m ,则B质量数为n ,则Y和n的值是( )
A.(X/2+18 ) 和 ( 2 m +18 ) B.(X/2+8 ) 和 ( 2 m +18 )
C.(X/2+8 ) 和 ( 2 m +36 ) D.(X/2+18 ) 和 ( 2 m+36 )
班级 姓名 总分
选择题答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 13 | 13 | 14 | 15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| |||||||
|
|
|
|
|
|
|
|
| |||||||
23.(8分)在短周期元素中:(用化学符号填空)
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)在室温下有颜色的气体单质是_____________。
(4)除稀有气体外,原子半径最大的元素是_________
(5)除稀有气体外,原子半径最小的元素是_____________。
(6)气态氢化物与最高价氧化物的水化物生成盐的元素是
(7)气态氢化物最稳定的化学式是_____________。
(8)最高价氧化物对应水化物的酸性最强的元素是_____________。
24.(9分)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是_______、B元素是_______、C元素是_______(用元素符号表示)
(2)D是由两种元素组成的双原子分子,其分子式是___________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是___________。
(4)F是由两种元素组成的三原子分子,其分子式是___________,电子式是____________。
(5)G分子中含有4个原子,其分子式是_____________。
(6)H分子中含有8个原子,其分子式是_____________。
25.(11分)短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素的名称是 ;Y元素的名称是 ;Z元素的名称是: 。
(2)XZ3化合物的分子式是 ,(2分)电子式是 。(2分)
(3)分别写出X、Y的含氧酸的分子式 、(2分) (2分)
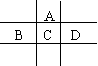 26.(17分)有A、B、C、D、E、F六种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E、F的阳离子与A的阴离子核外电子层结构完全相同,C、E、F的最高价氧化物的水化物两两之间都能反应生成盐和水
26.(17分)有A、B、C、D、E、F六种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E、F的阳离子与A的阴离子核外电子层结构完全相同,C、E、F的最高价氧化物的水化物两两之间都能反应生成盐和水
(1)写出下列元素的符号:
A________,E________ ,F (3分)
(2)A与E形成的化合物在物质的分类中应属于 (2分)
(3)A和F可形成既含有离子键又含有非极性共价键的化合物,用电子式表示该化合物的形成过程:
(2分)
(4)D和E形成的化合物在熔融状态下能否导电? (2分)
(5)C、D可形成分子式为C2D2的物质,该分子的电子式为 (2分)
(6)向D与E形成的化合物的水溶液中滴入烧碱溶液直至再无明显现象发生时,观察到的现象是_________________________ _,(2分)
有关反应的离子方程式为____________ 、 __ _ (4分)
27.(11分)今有A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与C、B与D分别是同族元素,B、D两种元素的质子数之和是A、C两元素质子数之和的两倍,这四种元素中有一种元素的单质易溶解于CS2溶剂中,回答下列问题
(1)写出下列元素的符号A B C D (4分)
(2)写出A2B2形成的化合物的电子式 (2分)
(3)写出化合物CA和化合物A2B反应生成A2的化学方程式: (2分)
(4)写出两种均含有这四种元素的化合物相互反应放出气体的化学方程式:
(3分)
附加题(1、2、3、4、6班必做)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
1.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新微粒是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法中正确的是( )
A.是氢的一种新的同素异形体 B.是氢的一种新的同位素
C.它的组成可用H3表示 D.它比一个普通H2分子多一个氢原子核
2.下列叙述正确的是( )
A.ⅡA族某元素原子序数为x,那么原子序数为x+1的元素位于ⅢA族
B.原子序数为27的元素位于周期表中四周期ⅧB
C.同主族两元素的原子序数可能相差44
D.115号元素可能是一种非金属
3.2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期
A ![]() 、第七周期 B 镭、第七周期 C 铼、第六周期 D 氡、第六周期
、第七周期 B 镭、第七周期 C 铼、第六周期 D 氡、第六周期
4.11g D218O所含的中子的物质的量为( )
A.4.5mol B.6mol C.5.5mol D.5mol
5.化合价为n的某元素的硝酸盐的式量为x,其氢氧化物的式量为y,则n的值是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
6.A、B、C、D四种非金属元素,A、B在反应中各结合1个电子形成稳定结构,放出能量B<A,氢化物稳定性HD>HA,原子序数C<B,其稳定结构的核外电子数相等,则四种元素非金属性由强到弱的顺序正确的是( )
A. A、B、C、D B. B、A、C、D C. D、A、B、C D. B、A、D、C
7.锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中Ge元素处于最高价态,铋
元素的价态与它跟氯形成某些共价化合物所呈的价态相同,且此氯化物中铋具有8电子稳定结构,可表
示为BixGeyOz则式中x等于( )
A.2z - 4y B.(2z – 4y)/3 C.(2z – 4y)/5 D.(2z – 3y)/5
8.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A. 18O 31P 119Sn B. 27Al 19F 12C
C.元素周期表中VA族所有元素的原子 D.元素周期表中第1周期所有元素的原子
9.某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿氏常数,下列说法中正确的是( )
A.氧元素的相对原子质量为12a/b B.1mol该原子质量为aNAg
C.x g该氧原子所含的电子数为16x/a D、y g 该氧原子的中子数一定为8y/a
10.同温同压下等体积的两容器中,分别充满14N,13C,18O三种原子构成的NO、CO。下列说法正确的是( )
A.分子数和质量均不相同
B.含有相同的质子和中子数
C.含有相同的分子数和中子数
D.含有相同数目的质子、中子和分子数
参考答案
23.(1)Na(2)F2(3)F2、Cl2(4)Na(5)H(6)N(7)HF(8)Cl
24.(1)K、Cl、S (2)HCl(3)F2(4)H2S(5)H2O2(6)C2H6
25.(1)氮 碳 氢(2)NH3(3)HNO3、H2CO3
26.(1)O、Al、Na(2)两性氧化物(4)不能(6)开始出现白色沉淀,后白色沉淀消失;
Al3++3OH—=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O
27.(1)H、O、Na、S(3)NaH+H2O=NaOH+H2↑
(4)NaHSO4+NaHSO3=Na2SO4+SO2↑+H2O