高一化学下期月考试题试题
![]() 第五章 物质结构 元素周期律
第五章 物质结构 元素周期律
说明:1、本试卷分第Ⅰ卷和第Ⅱ卷,共四道大题24道小题。考试时间90分钟,满分108分。
2、可能需要的相对原子质量数据H:1 C:12 N:14 O:16 F :19 S:32 Cl:35.5 Ca :40
第Ⅰ卷 (选择题 共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
一、选择题(每小题3分,共48分。每小题只有一个选项符合题意)
1、提出元素周期律并绘制了第一个元素周期表的科学家是
A.戴维 B.阿伏加德罗 C.门捷列夫 D.道尔顿
2、下列各组粒子中属于同位素的是
A.16O和18O B.H2O和D2O C.H2和D2 D.24Mg和24Na
3、元素性质呈现周期性变化的根本原因是
A.元素的相对原子质量递增,量变引起质变 B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
4、同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,
则下列判断正确的是
A.含氧酸的酸性:H3ZO4>H2YO4>HXO4 B.非金属性:Z>Y>X
C.气态氢化物的稳定性按X、Y、Z顺序由弱到强
D.下列反应可以发生:X2 + Y2- = 2X- + Y
5、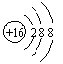 下列表达方式错误的是
下列表达方式错误的是
A.H∶Cl B.S2 -
C.![]() D.CO2分子的结构式: O=C=O
D.CO2分子的结构式: O=C=O
6、短周期元素X、Y的原子序数相差2,下列有关叙述正确的是 ( )
A. X与Y不可能位于同一主族 B. X与Y一定位于同一周期
C. X与Y不可能形成共价化合物XY D. X与Y可能形成离子化合物XY
7、下列递变情况中,正确的是
A.Na、Mg、Al原子的最外层电子数依次减少 B.Si、P、S元素的最高正价依次降低
C.C、N、O的原子半径依次减小 D.Li、Na、K的金属性依次减弱
8、某元素的最外层有 2 个电子, 该元素( )
A. 一定是金属元素 B.最高化合价一定为 +2 价
C.一定是 ⅡA 族元素或是 He D.无法确定属于哪类元素
9.设X、Y分别代表两种元素,且Xm+、Yn-两种离子的电子层结构相同,下列推断正确的是
A.原子序数:X<Y B.原子半径:X>Y
C.离子半径:Xm+>Yn- D.原子的最外层电子数:X>Y
10. 下列叙述中能肯定说明金属A比金属B的活泼性强的是 ( )
A.A原子最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多
D.常温时,A能从酸中置换出氢,而B不能
11.下列说法中不正确的是( )
A.在共价化合物中不可能含有离子键 B.非金属之间形成的化学键一定是共价键
C.含有共价键的化合物不一定是共价化合物 D.含有离子键的化合物一定是离子化合物
12..设NA为阿伏加德罗常数的值,下列说法不正确的是
A.1.54gCCl4中含有的共用电子对数为0.04NA
B.由2H和18O所组成的水11g,其中所含的中子数为6NA
C.1mol铵根离子中含有的电子数为9NA
D.在反应CaO+3C高温CaC2+CO↑中,若生成1molCO,则转移电子数为2 NA
13.下列各组物质的性质及粒子变化正确的是 ( )
A. 酸性:HClO4>H2SO4>H3PO4>H2CO3 B. 稳定性:H2S>HCl>HBr>HI
C. 粒子半径:Br—>K + >S2— >S D. 还原性:Na>S2— >Cl—>Br— >I-
14、下列电子式书写正确的是
![]()
A. O C O B.Ca [ Cl ]2 C.Na+ [ O O ]2- Na+ D.
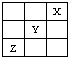 15、短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )
15、短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )
A.Z一定是活泼的金属 B.Y的最高价氧化物的水化物是一种强酸
C.Z的最高价氧化物的水化物是弱酸
D.1 molY单质跟足量水反应时,有2 mol电子发生转移
16、X和Y是短周期中的两种元素,可组成化合物XY2。当Y的原子序数为m时,X的原子序数可能是( )
①m-1 ②m-2 ③m-3 ④m-5 ⑤m+3 ⑥m+8 ⑦m-10
A. ①②⑥ B. ①②④⑥ C. ①②④⑤⑥⑦ D. ①③④⑤⑥
第Ⅱ卷 非选择题(共60分)
二、填空题(共43分)
17、(14分)下面是元素周期表的一部分,针对①—⑩元素填写下列空白
| 周期 主族 | IA | O | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | ||||||
(1)在这些元素中,属于金属元素的有__________(填元素符号)
(2)10种元素中原子半径最小的是_______(填序号)
(3)写出①和⑩形成的化合物的电子式_______________________
(4)用电子式表示④和⑥形成化合物的过程 。
(5)写出①和②的最低价形成气态分子的化学式______,判断分子为 。
(填极性分子或非极性分子)
(6)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
(7)⑨与⑩形成化合物的化学式 ,单质⑦通入该化合物中所得溶液呈 色。
18、(14分)有A、B、C、D、E五种元素,它们可能是原子或离子,且为短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素。金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍。D的气态氢化物水溶液显碱性,而其最高价氧化物水化物为强酸。E元素原子的最外层电子数比次外层电子数多4个,E离子的核外电子数比质子数多2个。
⑴写出A元素名称:____________,C2粒子的符号:________ ___。
⑵E的氢化物的分子式_________________。
⑶写出B与E化合的化学方程式:______________________、______________________。
⑷写出A的单质、 B的单质分别与水反应的溶液混合后发生的反应的离子方程式:_______________。
⑸A与C形成的化合物中含化学键类型是:__________,用电子式表示该化合物: ___________。
(6)分别用电子式表示A、B两元素和C、D两元素形成化学键的过程
_____ , 。
19、(4分)下列变化中
①NaCl 溶于水 ②HCl 溶于水 ③ O2 溶于水 ④Na2O2溶于水 ⑤ I2升华 ⑥固体NaOH熔化。
未发生化学键破坏的是 仅发生离子键破坏的是 ,仅发生共价键破坏的是 既发生离子键破坏,又发生共价键破坏的是 填序号)
| A | ||
| B | C | D |
20、(11分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
(1)五种元素的符号:【A______,B________,C________,D______,】E_________。
(2)C元素位于元素周期表中第 周期第 族;
(3)画出C原子、A离子的结构示意图:______________、______________
(4)B单质在D单质中燃烧,反应现象是___________,生成物的化学式为______________。
(5)A与E形成的化合物的化学式是_______,它的性质决定了它在物质的分类中应属于_______。
(6)向D与E形成的化合物的水溶液中滴入烧碱溶液直至再无明显现象发生时,观察到的现象是_________________________________,
有关反应的离子方程式为______________________、______________________。
三、实验题(12分)
21、(12分).动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体。 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③酒精灯,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
① ,② ,
(4)实验结论: , 。
三、计算题(本题共5分)
22、2.8g某单质A能从盐酸中置换出0.1g H2,同时生成ACl2;另一元素B,它的最高价氧化物的化学式为BO3。在B的氢化物中,B的质量分数为94.1%。
计算A、B两种元素的相对原子质量。
高一化学下期 第五章 物质结构 元素周期律 月考试题
参考答案和评分标准:
一、选择题(每小题3分,共30分。每小题只有一个选项符合题意)
1.C 2.A3.C 4.D 5 A 6 D 7.C8.D ;
9.B 10.D11. B 12.C 13.A 14.C 15.D 16. C
非选择题(13分)
二、填空题(共42分)
17、(14分)(每空2分) (1)⑤④⑨ (2)①
(5)CH4 非极性分子 (6)IVA族 (7)KBr呈 橙红 色。
![]()
![]() 18、(14分)⑴A:氟;C2:
18、(14分)⑴A:氟;C2:![]() H ⑵E的氢化物的分子式:H2O
H ⑵E的氢化物的分子式:H2O
![]() ⑶ 4Na+O2═2Na2O 2Na+O2 Na2O2 ⑷HF+OH-═F-+H2O
⑶ 4Na+O2═2Na2O 2Na+O2 Na2O2 ⑷HF+OH-═F-+H2O
⑸共价键,HF的电子式:
(6)用电子式表示A、B两元素形成化学键的过程
![]()
![]()
19、(4分)③ ⑤、①⑥、②、④
20.
|
![]() (2)三;ⅤⅠA
(2)三;ⅤⅠA
|
|
|
|
(6)先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清
Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
三、实验题
21、(12分)(1) (1分)同周期 (2) (2分)试管、烧杯、
(3) (3分)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象 | B | F | A | C | D | E |
①(2分)Mg+2H2O![]() 2Mg(OH)2+H2↑
②(2分)Na2S+Cl2
=2NaCl+S↓(每空2分)
2Mg(OH)2+H2↑
②(2分)Na2S+Cl2
=2NaCl+S↓(每空2分)
|
四、计算题(本题共6分)
22、(6分)解:
A+2HCl=ACl2+H2↑
Ar(A) 2
2.8g 0.1g
![]()
![]()
已知B的最高价氧化物的化学式为BO3。所以B的氢化物化学式为H2B。
根据题意得:
![]() Ar(B)=32
Ar(B)=32
答:A、B两种元素的相对原子质量分别是56,32。